Капиллярный лечебный зонд в предоперационной подготовке больных с пилородуоденальным язвенным стенозом
Капиллярный лечебный зонд в предоперационной подготовке больных с пилородуоденальным язвенным стенозом.
С.В. Стоногин, А.Г. Шерцингер, Л.Я. Тимен, А.И. Черепанин
ГКБ № 20 г. Москвы
(Заведующий отделом экстренной хирургии научного центра хирургии РАМН профессор А.К. Ерамишанцев)
Язвенная болезнь (ЯБ) желудка и двенадцатиперстной кишки имеет тенденцию к массовому распространению, что приводит к потере трудоспособности взрослого населения России [1]. В настоящее время возросла распространенность хронической, резистентной к лечению и склонной к развитию пилородуоденального стеноза язвы пилородуоденальной локализации [2]. Органический язвенный стеноз и деформация желудка с нарушением эвакуации является абсолютным показанием к оперативному лечению [3]. Большинство больных с данной патологией, поступающих в хирургические стационары в настоящее время представляют собой тяжелый контингент, что связано с длительностью заболевания, а также наличием у больных одного или нескольких тяжелых сопутствующих заболеваний. Хирургическое лечение больных с органическим язвенным пилородуоденальным стенозом, длительно незаживающим язвенным дефектом, а также с тяжелой сопутствующей патологией сопровождается большим числом послеоперационных осложнений и высокой летальностью [4]. Летальность после экстренных операций, выполненных по поводу пилородуоденального стеноза, у больных с высоким операционно-анестезиологическим риском значительна и колеблется от 10% до 44.4% [5]. Высокая послеоперационная летальность после проведения экстренных операций по поводу язвенного стеноза связана с отсутствием полноценной предоперационной подготовки [6]. После плановых операций по поводу данной патологии летальность составляет 3.9%-5% [7, 8, 9].
Тактика ведения больных с язвенным пилородуоденальным стенозом при наличии у них высокого операционно-анестезиологического риска изучена недостаточно [10]. По мнению S.W. Chau 1992 и G. Zuccala 1994 у больных данной группы необходимо определить все факторы операционно-анестезиологического риска до операции и провести их коррекцию во время предоперационной подготовки [11, 12]. Проведение адекватной предоперационной подготовки у больных с язвенным стенозом позволяет скорригировать нарушения гомеостаза, вызванные как основной патологией, так и тяжелыми сопутствующими заболеваниями. Благодаря этому удается снизить степень операционно-анестезиологического риска, послеоперационную летальность и количество послеоперационных осложнений.
В настоящее время актуальным является поиск новых патогенетических методов диагностики и лечения больных с язвенным пилородуоденальным стенозом, а также разработка новых методов предоперационной подготовки в группах высокого операционно-анестезиологического риска.
Целью исследования, проведенного группой авторов в отделении экстренной хирургии и портальной гипертензии (заведующий отделением экстренной хирургии и портальной гипертензии доктор медицинских наук, профессор А.К. Ерамишанцев) Российского научного центра хирургии РАМН (директор академик РАМН Б.А. Константинов) на базе городской клинической больницы N20 г. Москвы (главный врач Л.Л. Тутанцев), явилось улучшение результатов лечения больных с язвенной болезнью желудка и двенадцатиперстной кишки, осложненной пилородуоденальным стенозом и имеющих высокую степень операционного риска.
Задачами исследования явились:
- Изучить течение болевого синдрома и сроки рубцевания язвенных дефектов у больных с язвенной болезнью желудка и двенадцатиперстной кишки, осложненной пилородуоденальным стенозом при лечении с использованием капиллярного лечебного зонда в сравнении с традиционными методами лечения.
- Изучить влияние применения капиллярного лечебного зонда на моторно-эвакуаторную и кислотопродуцирующую функции желудка и двенадцатиперстной кишки у больных с язвенной болезнью желудка и двенадцатиперстной кишки, осложненной пилородуоденальным стенозом.
- Разработать алгоритм лечебной тактики ведения больных с язвенной болезнью желудка и двенадцатиперстной кишки, осложненной пилородуоденальным стенозом, с применением капиллярного лечебного зонда.
- Оценить влияние применения капиллярного лечебного зонда в комплексе предоперационной подготовки больных с язвенной болезнью желудка и двенадцатиперстной кишки, осложненной пилородуоденальным стенозом, на степень операционно-анестезиологического риска.
- Провести сравнительную оценку эффективности комплексного лечения больных с язвенной болезнью желудка и двенадцатиперстной кишки, осложненной пилородуоденальным стенозом с высоким операционно-анестезиологическим риском традиционными методами и с использованием капиллярного лечебного зонда.
Содержание работы.
В исследовании представлены результаты лечения 107 больных язвенной болезнью желудка и двенадцатиперстной кишки, осложненной пилородуоденальным стенозом. Исследованием охвачен 10-летний период с 1986 по 1996 год. С 1993 года в лечении данной патологии начал применяться капиллярный лечебный зонд (КЛЗ).
Все больные были разделены на 2 группы - в основную группу 43 человека были включены больные язвенной болезнью желудка и двенадцатиперстной кишки, осложненной стенозом пилородуоденальной зоны, в лечении которых использовался КЛЗ: в подгруппу 1А вошли те пациенты, в лечении которых КЛЗ использовался в сочетании с ЭЗП, диетотерапией, противоязвенной фармакотерапией и лечебной эндоскопией (у больных с функциональным компенсированным пилородуоденальным стенозом на фоне обострения язвенной болезни); в подгруппу 1Б - пациенты, в лечении которых использовалось оперативное вмешательство после коррекции белково-энергетической недостаточности и нарушений гомеостаза (больные с признаками органического пилородуоденального стеноза, белково-энергетической недостаточностью, выраженными моторно-эвакуаторными нарушениями). Средний возраст больных основной группы составил 50 + 1,3 лет. Среди них: больных с язвенной болезнью желудка 16%, с язвенной болезнью двенадцатиперстной кишки 77%, с язвенной болезнью желудка и двенадцатиперстной кишки 7%.
В контрольную группу (64 человека) вошли больные, в лечении которых были применены традиционные способы фармакотерапии и оперативного лечения и КЛЗ не использовался. Средний возраст больных контрольной группы составил 49+1,2 лет. Из них: больных с язвенной болезнью желудка 28%, с язвенной болезнью двенадцатиперстной кишки 67%, с язвенной болезнью желудка и двенадцатиперстной кишки 5%.
Большую часть больных по возрасту в обеих группах составили пациенты старше 60 лет (44%). Достоверных различий в основной и контрольной группах при распределении больных по полу, возрасту не наблюдалось (p>0.01).
Средний возраст больных, сроки язвенного анамнеза не имели статистически достоверных различий в обеих группах. Средние сроки язвенного анамнеза составили для больных основной и контрольной группы 12+2 и 11.5+1.7 лет соответственно (p>0.01). Средние размеры язвенного дефекта у больных основной и контрольной групп по данным ЭГДС были 16+1.3 и 14+1.2 мм (p>0.01).
Большую часть больных (71%) составили пациенты с локализацией язвенного дефекта в луковице двенадцатиперстной кишки, больных с локализацией язвенного дефекта в пилорическом отделе желудка было 23%, меньшую часть составили больные с пилоробульбарной локализацией язвенного дефекта – 6% больных.
Основную долю пациентов составили больные с субкомпенсированным пилородуоденальным стенозом (77% больных), больных с декомпенсированным стенозом было 16%, самую незначительную часть составили больные с компенсированным стенозом – 7% больных.
С нормальным состоянием питательного статуса было 2% больных. Пациентов с легкой степенью нарушения питания было 18%, со средней степенью-69% и с тяжелой степенью было 11% больных. Достоверных различий в основной и контрольной группах по степени нарушения питания не наблюдалось (p>0.01). Нарушения водно-электролитного баланса выражались в гипогидратации, снижении массы тела, снижении артериального и центрального венозного давления, гемоконцентрации, гипонариемии, гипокалиемии, гипохлоремии, метаболическом алкалозе. Указанные изменения были наиболее выражены у больных с декомпенсированным пилородуоденальным стенозом.
Помимо нарушения питания у больных основной и контрольной групп было одно или более тяжелое сопутствующее заболевание, что повышало степень ОАР. Среди сопутствующих заболеваний и синдромов встречались: ИБС, почечная недостаточность, печеночная недостаточность, онкологические заболевания, сахарный диабет, последствия ОНМК, легочная недостаточность. У 91% больных основной и контрольной групп было в наличии хотя бы одно, а у 85% больных основной группы и у 83% больных контрольной группы было более одного тяжелого конкурирующего заболевания. Только у 3% больных наблюдалась мономорбидность. Диагностика, оценка степени тяжести течения сопутствующих заболеваний и их коррекция проводились с участием профильных специалистов – реаниматолога, терапевта, эндокринолога.
Операционно-анестезиологический риск оценивали по критериям классификации Московского научного общества анестезиологов-реаниматологово 1988 года.
Среди всех больных преобладали пациенты с высокой степенью ОАР – 66%, больных с крайне высокой степенью ОАР было 34%. Достоверных различий между больными основной и контрольной группы по степени ОАР не было (p>0.01).
Клинические методы исследования больных, использованные в работе
Наряду с общепринятыми клиническими анализами, больным проводили антропометрические измерения с целью определения степени нарушения питания: измерение массы тела (кг), толщины кожной складки плеча (см), объема мышц и окружности средней трети плеча (см), биохимические исследования (содержание общего белка и его фракций в сыворотке крови (г/л), величину азотистого баланса (г), уровни креатинина, билирубина, гликемии, хлоридов).
Нами использовалась следующая программа инструментального обследования больных, приведенная в таблице 1.
Таблица 1
| Программа обследования больных |
|
ЭГДС (в 1-е и 9-11-е сутки) проводили либо в кабинете диагностической эндоскопии у больных, находящихся в удовлетворительном состоянии, либо в операционной у больных, находящихся в тяжелом состоянии. ЭГДС позволяла оценить локализацию, размеры и характер язвы, явлений стеноза, дуоденогастрального рефлюкса и оценить его степень (1-й 2-й и 3-й степени по классификации Тополянского В.Д.- Тимена Л.Я. [13, 14]. При этом проводили необходимые лечебные манипуляции; производилось исследование желудочной секреции с помощью внутрижелудочной рН-хромоскопии по методу Тимена Л.Я.
Кислотность желудочного сока в данном исследовании проводили с помощью метода внутрижелудочной рН-хромоскопии по методу Л.Я. Тимена [13, 14]. Во время эндоскопического исследования индикаторы вводили через тефлоновый зонд пристеночно на слизистую оболочку желудка и двенадцатиперстной кишки. Уровень секреции свободной HCL в желудке и ощелачивующую функцию антрального отдела желудка оценивали по методике Ю.Я. Лея [13, 14]. Методика применялась для оценки степени дуоденогастрального рефлюкса, изучения секреции желудка и двенадцатиперстной кишки при язвенной болезни желудка и двенадцатиперстной кишки, контроля полноты ВТ до и во время органосохраняющих операций.
Следующим диагностическим этапом являлось компьютерное радиоизотопное сканирование желудка и двенадцатиперстной кишки (на 2-3-е сутки и повторно на 6-8 сутки) с использованием в качестве радиофармпрепарата (РФП) Тх 99м пертехнетата в дозе 0,2 МБК/кг по оригинальной методике. Метод позволял нам оценить скорость эвакуации РФП из желудка и двенадцатиперстной кишки по периоду полутранзита и остаточной активности, степень дуоденогастрального и гастроэзофагеального рефлюкса, локализацию изменений в желудке и двенадцатиперстной кишке, их форму и размер, решить вопрос о проведении патогенетически обоснованного лечения и выбора метода оперативного вмешательства, а также оценить эффективность различных видов операций на желудке и ДПК с точки зрения сохранения или восстановления утраченной моторно-эвакуаторной функции.
Принцип методики заключался в наружном детектировании последовательных изменений скорости счета над областью желудка после приема натощак жидкого РФП. В процессе исследования использовалась сцинтилляционная гамма камера “Segams”, оснащенная ЭВМ и ингоканальными анализаторами.
За основу исследования была взята оригинальная методика, суть которой заключалась в том, что больной принимал РФП Тх99m в дозе 0,08 МБК/кг болюсно в растворе (50мл) натощак в 9-00. Оптимальным являлось положение пациента "сидя в зубоврачебном кресле" с наклоном 30-40 градусов по вертикали. Для основного контингента больных ЯБЖ и ДПК время исследования составляло 20-30 минут, для пациентов с подозрением на замедление эвакуации – 60-120 минут. Начало записи совпадало с моментом окончания приема жидкого РФП. В результате исследования врач располагал серией изображений на экране ЭВМ, динамическими кривыми перераспределения РФП между желудком и тонкой кишкой, а также количественным показателем времени половинного опорожнения желудка (Т1/2).
В норме на первых минутах исследования изображение желудка имеет форму перевернутой реторты. При нормальном состоянии моторно-эвакуаторной функции желудка в течение 20-30 минут исследования в положении сидя РФП заполнял петлю ДПК и частично переходит в тонкую кишку.
Рисунок 1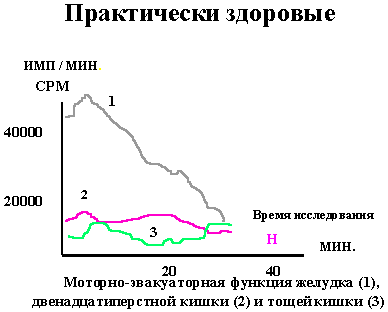 |
На рисунке 1 показано изображение моторно-эвакуаторной функции желудка (1), двенадцатиперстной кишки (2) и тощей кишки (3) у практически здорового человека. По оси абсцисс отложена шкала времени в минутах, а по оси ординат - активность радиофармпрепарата над заданными зонами исследования (имп/мин). Отмечается достаточно быстрая эвакуация препарата из желудка, из двенадцатиперстной кишки и накопление его в тощей кишке. |
Первое рентгенологическое исследование больным проводили на 2-3 сутки после поступления в стационар. В качестве контрастного вещества использовали водную взвесь бария сульфата концентрацией 1:2 При рентгеноскопии желудка первым этапом исследования являлось изучение рельефа слизистой оболочки с помощью дозированной компрессии и пальпации. Вторым этапом исследования являлось изучение желудка при тугом наполнении его контрастным веществом .
Затем проводили полипозиционное исследование, заключающееся в придании больному кроме вертикального положения (ортоскопии) горизонтального на спине, животе при вертикальном ходе рентгеновских лучей (Трохоскопии), положения Тренделенбурга, положения на боку при горизонтальном ходе рентгеновских лучей (латероскопия), на животе.
Исследование во всех этих положениях было необходимо для того, чтобы с помощью произведенных прицельных снимков дать заключение о состоянии всех отделов желудка, всех его стенок.
После постановки КЛЗ на 6-8 сутки проводили рентгеновское исследование желудка и двенадцатиперстной кишки с контрастированием зонда 10-20 мл водо-растворимого контраста (урографин) для контроля его положения в зонах водителей ритма и определяли наличие паразондовой эвакуации контрастного вещества, введенного per os или ее отсутствие.
Методика постановки капиллярного лечебного зонда
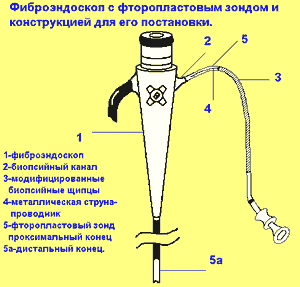
По показаниям больному проводилась ЭГДС (эндоскопами IT и К2 фирмы “Olympus“ (Япония) с постановкой капиллярного лечебного зонда (в первые сутки). КЛЗ представлял собой тефлоновый или фторопластовый катетер длиной 1,5-2 м с наружным диаметром 3мм и внутренним - 2мм.
Рентгенограмма 1
 Зонд устанавливался во время ЭГДС врачом-эндоскопистом и ассистентом под контролем электроннооптического преобразователя по оригинальной методике Л.Я. Тимена (патент Российской Федерации № 2082326 от 27.06.97) [15] с целью длительного воздействия на зоны водителей ритма желудка и ДПК(фундальном отделе и теле желудка, пилорическом канале, области Фатерова соска и связки Трейтца) посредством сформированных в этих отделах петель. Формирование петель проводилось для исключения возможного быстрого выпадения зонда и для увеличения площади контакта КЛЗ с зонами интрамуральных нервных сплетений и водителей ритма [16, 17]. Для сравнения при постановке капиллярного зонда без формирования петель болевой синдром стихал в те же сроки, но эвакуация бария и рфп наступала на 10-15 минут позднее и в некоторых случаях отмечалось выпадение дистального отрезка зонда в желудок (на 3-4-е сутки). При компенсированном ПДС достижение проксимального отдела тощей кишки выполнялось путем “сборивания” 12-перстной кишки. При этом ассистентом производились повороты пациента на спину, живот и противоположный бок, а также использовалось ручное пособие (фиксация брюшной стенки в различных отделах. Проталкивание КЛЗ и введение его в просвет желудка и тонкой кишки производилось с помощью толкателя (модифицированных биопсийных щипцов).
Зонд устанавливался во время ЭГДС врачом-эндоскопистом и ассистентом под контролем электроннооптического преобразователя по оригинальной методике Л.Я. Тимена (патент Российской Федерации № 2082326 от 27.06.97) [15] с целью длительного воздействия на зоны водителей ритма желудка и ДПК(фундальном отделе и теле желудка, пилорическом канале, области Фатерова соска и связки Трейтца) посредством сформированных в этих отделах петель. Формирование петель проводилось для исключения возможного быстрого выпадения зонда и для увеличения площади контакта КЛЗ с зонами интрамуральных нервных сплетений и водителей ритма [16, 17]. Для сравнения при постановке капиллярного зонда без формирования петель болевой синдром стихал в те же сроки, но эвакуация бария и рфп наступала на 10-15 минут позднее и в некоторых случаях отмечалось выпадение дистального отрезка зонда в желудок (на 3-4-е сутки). При компенсированном ПДС достижение проксимального отдела тощей кишки выполнялось путем “сборивания” 12-перстной кишки. При этом ассистентом производились повороты пациента на спину, живот и противоположный бок, а также использовалось ручное пособие (фиксация брюшной стенки в различных отделах. Проталкивание КЛЗ и введение его в просвет желудка и тонкой кишки производилось с помощью толкателя (модифицированных биопсийных щипцов).
Рисунок 2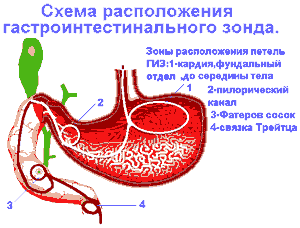 |
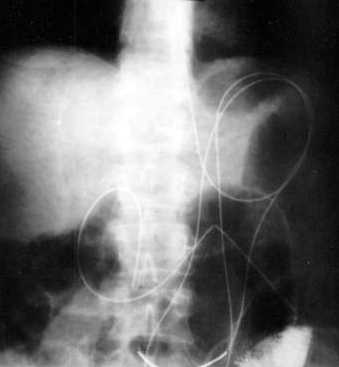
На рисунке 2 показана схема установки зонда в четырех зонах водителей ритма. На рентгенограмме 1 больного M. с установленным КЛЗ (контрастирован раствором урографина) в 4-х зонах водителей ритма. |
|
Рисунок 3 |
На рисунке 3 показан момент введения зонда (5), насаженного на металлическую струну (4) модифицированных биопсийных щипцов (3) в биопсийный канал эндоскопа. |
Рисунок 4 Рисунок 5  |
На рисунке 4 приведено изображение модифицированных биопсийных щипцов (1), использующихся в качестве толкателя с напаянной на них металлической струной-проводником (2), а на рисунке 5 можно видеть фторопластовый зонд вместе с проводником и толкателем. |
Рисунок 6 |
Рисунок 6 отражает принцип фиксации зонда лейкопластырем в области верхней губы, наружного угла глаза и лобной области. |
Рентгенограмма 2
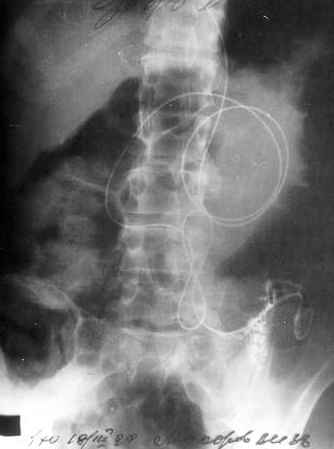 В случаях суб- и декомпенсированного пилородуоденального стеноза, когда не удавалось завести эндоскоп за зону сужения, КЛЗ устанавливался из антрального отдела желудка под рентгенологическим контролем. При этом можно было менять положение пациента на столе и использовать помощь ассистента (лечащего врача или медсестры эндоскопического кабинета) - дозированную компрессию и пальпацию живота для лучшего продвижения КЛЗ за зону ПДС. При субкомпенсированном ПДС по возможности формировали петли в желудке и ДПК. При декомпенсированном ПДС петли удавалось формировать только в желудке (Рентгенограмма 2).
В случаях суб- и декомпенсированного пилородуоденального стеноза, когда не удавалось завести эндоскоп за зону сужения, КЛЗ устанавливался из антрального отдела желудка под рентгенологическим контролем. При этом можно было менять положение пациента на столе и использовать помощь ассистента (лечащего врача или медсестры эндоскопического кабинета) - дозированную компрессию и пальпацию живота для лучшего продвижения КЛЗ за зону ПДС. При субкомпенсированном ПДС по возможности формировали петли в желудке и ДПК. При декомпенсированном ПДС петли удавалось формировать только в желудке (Рентгенограмма 2).
При суб- и декомпенсированных ПДС достигнуть проксимального отдела тощей кишки удавалось в 70% случаев. Место положения КЛЗ после его установки контролировалось при рентгеноскопии через электроннооптический преобразователь путем внутри просветного введения в КЛЗ 10-20 мл раствора урографина, что позволяло хорошо контрастировать весь КЛЗ. На 2-3-е сутки после постановки зонда проводились первичное радиоизотопное и рентгенологическое исследования. После постановки КЛЗ на 6-8 сутки проводились контрольное радиоизотопное и рентгенологическое исследования.
Проводились также антропометрические исследования (измерение массы тела, толщины кожной складки плеча, объема мышц и окружности средней трети плеча).
Схема комплексного лечения язвенной болезни желудка и двенадцатиперстной кишки, осложненной пилородуоденальным стенозом
Нами была разработана 3-х этапная схема комплексного лечения язвенной болезни желудка и двенадцатиперстной кишки, осложненной стенозом выхода из желудка.
I этап - энтеральное зондовое питание 5-7 дней через КЛЗ.
II этап:
А - ЭЗП не проводится, а капиллярный лечебный зонд сохраняется для транзитной поддержки химуса в сочетании с диетотерапией и противоязвенной фармакотерапией у больных с суб- и декомпенсированным стенозом, а также компенсированным ПДС с выраженным стойким абдоминальным болевым синдромом 10-14 дней
Б - оперативное лечение у больных с органическим компенсированным, субкомпенсированным и декомпенсированным ПДС после коррекции белково-энергетической недостаточности и нарушений гомеостаза
III этап - лечебная эндоскопия у больных с замедленной репарацией в зоне язвенного дефекта (2 раза в неделю 10-14 дней).
На первом этапе проводилось энтеральное зондовое питание (ЭЗП) сбалансированными молочными смесями типа “Изокал”, ”ОВОЛАКТ” (концентрацией от 10 до 30%, содержат вещества, слабо возбуждающие секрецию и мало раздражающие слизистую оболочку тонкой кишки, оптимальное соотношение заменимых и незаменимых аминокислот за счет обогащения белковой компоненты смеси цельным белком куриного яйца) с ароматизированной добавкой (энергетическая емкость 1 ккал/мл) или мясными бульонами, из расчета 3000 - 3500 ккал / сутки. Показанием к энтеральному зондовому питанию считали выраженную белково-энергетическую недостаточность у больных с язвенной болезнью, осложненной декомпенсированным органическим стенозом пилородуоденальной зоны, выраженные моторно-эвакуаторные нарушения, исключавшие возможность перорального питания.
Смесь “Оволакт“ готовили путем растворения сухого порошка в питьевой воде комнатной температуры. В зависимости от необходимого калоража (0,5-1,0-1,5 ккал/ мл) растворяли 100, 200 и 300 мг порошка в объеме 900 - 700 мл. Соотношение белков, жиров и углеводов по калорийности составляет от 1: 1 : 1 до 6 : 3 : 3; утилизация 1 г азота обеспечивает 147 ккал (коэффициент К / А = 147). Осмолярность раствора 560 мосмоль /л Н2О. Приготовленная смесь пригодна к использованию в течение суток. Входящие в состав смеси вкусовые добавки и ароматизаторы позволяли при необходимости применять “Оволакт“ в виде напитка. Для оценки переносимости энтерального питания стартовый режим введения был не более 100 - 150 мл 10 - 30 % раствора “Оволакта“ (0,1 - 0, 3 ккал ./ мл в час).
При отсутствии схваткообразной боли, кишечного дискомфорта через 2 -3 часа объем введения увеличивали до 200 - 250 мл / час. При хорошей переносимости ЭЗП к концу суток проводили питание чистой еюнальной смесью, что обеспечивало поступление 2000 - 3000 ккал / сутки. В целом в первые 2 дня от начала ЭЗП ограничивали общую дозу смеси или вводили ее дробно по 200 мл 3 раза в день, не более 600 мл за сутки. Смесь вводили при дробном введении в 6 ч утра и в 22 часа, а при капельном ее введении скорость была 40 - 60 капель в минуту, что обеспечивало хорошее всасывание и не вызывало диспепсических расстройств. Для профилактики функциональных нарушений деятельности кишечника вводимую питательную смесь подогревали до 37 - 38 градусов. Равномерность темпа поступления обеспечивали дозирующей системой с соблюдением физиологического интервала между кормлениями 2 раза в сутки. На период ЭЗП общепринятую противоязвенную терапию не назначали.
При приготовлении жидкой смеси “Изокал” сухая смесь разводилась в предварительно прокипяченной и охлажденной до температуры ниже 40 0С воде при простом перемешивании или перемешивании при помощи миксера. Растворяли сухую смесь в 2/3 объеме воды, затем добавляли оставшуюся 1/3 и тщательно перемешивали. При прерывистом капельном режиме питания первые 100 мл вводили в течение 20-30 минут, следующие 100 мл – через 2 часа от начала первого кормления (перерыв между кормлениями 1.5 часа), при хорошей переносимости скорость введения увеличивали с 5 до 10мл/мин, при этом при фиксированном времени начала каждого последующего кормления время введения каждой порции составляло 15-40 мин, интервал между введением -1час 20 мин – 1час 45 мин. Для введения смеси использовались капельницы. Каждые 4 часа КЛЗ промывался 30-50 мл физиологического раствора [18].
Инфузионную терапию проводили только больным с декомпенсированным стенозом с крайне тяжелыми проявлениями белково-энергетических и водно-электролитных нарушений при невозможности проведения КЛЗ из-за стеноза или сочетали с ЭЗП. Перед началом парентерального питания проводили коррекцию гипогидратации, нарушений электролитного обмена, ОЦК, реологических свойств крови, микроциркуляции. Для этой цели больному вводили растворы глюкозы, солевые, плазмозамещающие препараты. В среднем объем солевых растворов составлял 1000-1500 мл. С целью коррекции коллоидно-осмотического состояния крови больным вводили плазму, альбумин, протеин, содержащие цельные белки крови, способные к длительной циркуляции. Целью вводной инфузионной терапии являлось: устранение гемодинамических расстройств и восполнение ОЦК, ликвидация нарушений водно-электролитного и кислотно-основного состояния. На 1 этапе добивались нормализации диуреза, снижения гематокрита, нормализации показатели КОС. Для пластических целей использовали препараты аминокислот, различавшихся по количественному и качественному составу: полиамин, альвезин, гидролизаты белка. Энергетический дефицит восполняли введением растворов глюкозы, жировых эмульсий, этилового спирта. Потребность во вводимых с растворами белках, жирах, углеводах рассчитывалась исходя из суточной потребности в них, а именно в среднем: белка - 0,7- 1,0 г на килограмм массы тела; жира - 60 - 70 г; углеводов - 200 г. Каждый грамм азота должен быть обеспечен 150 ккал для его усвоения. При тяжелых операциях потребность во вводимых компонентах возрастала в среднем в 2 раза. Средний срок парентерального питания составлял 10 дней, так как обновление структурного белка в гепатоцитах происходит за 7 дней, а в мышечной ткани - за 17 дней. Поскольку парентеральное питание проводилось дольше 5 дней, больным катетеризировали одну из центральных вен.
Основными методами контроля эффективности парентерального питания и ЭЗП служили измерение массы тела, измерение объема плеча и толщины кожной складки в области трехглавой мышцы плеча; определение потерь общего азота с мочой, азотистого баланса определение содержания белка, белковых фракций в сыворотке крови.
Противопоказаниями к проведению ЭЗП служили отек мозга, декомпенсированные формы сердечно-сосудистой и легочной недостаточности, признаки гипергидратации организма, острая почечная и (или) печеночная недостаточность.
Длительность 1-го этапа консервативного лечения (ЭЗП) составила в среднем 5-7 дней и определялась клинической динамикой, результатами рентгенологического и радионуклидного исследований.
Второй этап заключался: подгруппа А – ЭЗП не проводили, а капиллярный лечебный зонд сохраняли для транзитной поддержки химуса в сочетании с диетотерапией и противоязвенной фармакотерапией у больных с суб- и декомпенсированным стенозом, а также компенсированным ПДС с выраженным стойким абдоминальным болевым синдромом. Моторно-эвакуаторные нарушения (МЭН) выявляли клинически (тошнота, рвота, изжога, аэрофагия, отрыжка), эндоскопически (синдром “раздраженного желудка”, различная степень дуоденогастрального рефлюкса), радионуклидным методом и рентгено-гастрографией с барием). При субкомпенсированном ПДС пища была малого объема и высокой энергетической ценности, с достаточным содержанием белков, жиров и легко растворимых углеводов. Хорошо протертую пищу (Диета 1A) давали небольшими порциями через 3 часа. Энергетическая ценность рациона составляла 2000-2500 ккал, содержал количество белка, соответствующее оптимальному (80-90 г), соотношение животного и растительного белка было 1:1. Жировая часть рациона составляла 80 г, из которых 20 - 25 г относились к растительным маслам. Углеводная часть рациона не превышала 250-300 г, при этом контролировалось содержание простых углеводов, количество которых не выходило за пределы 50 г. Длительность второго этапа составила 10-14 дней.
В группе Б - оперативное лечение в случае неэффективности первого этапа консервативного лечения (отсутствии рубцевания язвы, сохранении признаков декомпенсированного органического стеноза пилородуоденальной зоны) после коррекции белково-энергетической недостаточности, нарушений гомеостаза и сопутствующей патологии.
Третий этап лечебной эндоскопии проводился больным, у которых отмечалась замедленная динамика репаративного процесса в зоне язвы. Лечебная эндоскопия проводилась на 10-14 сутки после постановки КЛЗ и включала подслизисто-мышечное введение под края язвы 0,5% водного раствора метиленового синего [19, 20, 21, 22, 23, 24, 25, 26, 27] и 5% раствора аскорбиновой кислоты, орошение поверхности язвы и перифокальной зоны хлорэтилом 2 раза в неделю 10-14 дней.
Анализ результатов лечения больных основной и контрольной групп
Оценка эффективности разработанной тактики лечения больных с язвенным ПДС и высоким ОАР производилась по следующим параметрам: 1) -влиянию КЛЗ на сроки купирования болевого синдрома и ликвидацию моторно-эвакуаторных нарушений; 2) -влиянию КЛЗ на сроки рубцевания язвенных дефектов у больных с язвенным ПДС; 3) -влиянию КЛЗ на результаты консервативного и оперативного лечения больных с язвенным ПДС и высоким ОАР.
Средние сроки ликвидации болевого синдрома и нормализации моторно-эвакуаторной функции желудка и двенадцатиперстной кишки в основной и контрольной группах оценивались в днях и представлены в таблице 2.
Таблица 2
Средние сроки ликвидации болевого синдрома и начала коррекции моторно-эвакуаторной функции в днях (М+ м)
| Группы больных | Основная группа(1)(N = 43) | Контрольная группа (2)(N = 64) | Достоверность различий - P(1-2) |
| Вид стеноза | |||
| Компенсированный | 1+0,5 | 3+2 | p>0.01 |
| Субкомпенсированный | 2+1,3 | 7+1,5 | p<0.01 |
| Декомпенсированный | 3+1.2 | 9+1.5 | p<0.01 |
Из таблицы видно, что средние сроки ликвидации болевого синдрома и начала коррекции моторно-эвакуаторной функции желудка и ДПК в основной и контрольной группах зависели от степени ПДС и были минимальными при компенсированном ПДС (1+0,5 и 3+2 соответственно у больных основной и контрольной групп) и максимальными при декомпенсированном ПДС (3+1.3 и 9+1.8 соответственно у больных основной и контрольной групп). В обеих группах больных средние сроки ликвидации болевого синдрома и коррекции моторно-эвакуаторных нарушений были в 3 раза ниже при компенсированном ПДС, чем при декомпенсированном ПДС. При субкомпенсированном ПДС указанные сроки составили 2+1,5 и 7+2 соответственно у больных основной и контрольной групп. Сроки ликвидации болевого синдрома у больных основной и контрольной групп при компенсированном ПДС достоверно не отличались (p>0.01). Однако, больным основной группы удавалось достоверно раньше купировать болевой синдром (р<0.01) и корригировать моторно-эвакуаторные нарушения, чем больным контрольной группы при субкомпенсированном и декомпенсированном ПДС, несмотря на то, что у больных контрольной группы интенсивнее использовались фармакологические противоязвенные способы воздействия на различные звенья патогенеза язвенной болезни. В среднем сроки ликвидации болевого синдрома и коррекции моторно-эвакуаторных нарушений были в 3 раза ниже в основной группе.
Влияние капиллярного лечебного зонда на сроки рубцевания язвенных дефектов у больных с язвенным пилородуоденальным стенозом
Рубцевание язвенного дефекта является важнейшим объективным признаком излечения или достижения ремиссии при язвенном ПДС. Задержка рубцевания или его полное отсутствие является неблагоприятным прогностическим фактором при лечении больных с язвенным ПДС. Сроки рубцевания язвенных дефектов у больных основной и контрольной групп оценивались в днях. Процесс рубцевания контролировался во время динамической ЭГДС. Средние сроки рубцевания язв пилородуоденального отдела желудка у неоперированных больных основной группы на фоне присутствия КЛЗ были достоверно ниже и составили 17+1.3 дней. У больных контрольной группы сроки рубцевания язвенных дефектов составили 26+2.1 (p<0.01). Следует подчеркнуть, что сроки появления первых признаков рубцевания язвенных дефектов совпали со сроками ликвидации болевого синдрома и коррекции моторно-эвакуаторных нарушений. По данным литературы [28] средние сроки рубцевания язв желудка на фоне лечения составляют 6-8 недель, язв двенадцатиперстной кишки- 4-6 недель [29]. Условия работы хирургической клиники в рамках больницы скорой помощи диктовали необходимость выписки больных в стадии формирования красного (незрелого) рубца с последующим амбулаторным долечиванием.
Влияние КЛЗ на кислото-выделительную функцию желудка у больных с пилородуоденальным язвенным стенозом
При дуоденальных и пилоробульбарных язвах была выявлена гиперхлоргидрия желудочного сока (рН<1,5). Гиперхлоргидрия наблюдалась у больных с язвенными пилородуоденальными стенозами у больных основной группы в стадии компенсации, субкомпенсации и декомпенсации во всех случаях, когда они не получали H2 блокаторов и Н+блокаторов желудочной секреции.
Рубцевание пилородуоденальных язв не сопровождалось изменением кислотопродуцирующей функции желудка у 72 больных основной и контрольной групп, получавших метацин, гастроцепин, альмагель, викалин, но-шпу (p<0,01) (по данным контрольной внутрижелудочной рН хромоскопии), что говорит нам о том, что КЛЗ не влияет на кислотопродуцирующую функцию желудка (pH<1.5). Измерения рН производились при поступлении, на 6 день лечения и на 9 день лечения у больных основной и контрольной групп. У больных основной группы с компенсированным ПДС значения рН составили, у больных контрольной группы – pH<1.5. У больных основной группы с субкомпенсированным ПДС значения рН составили pH<1.5, у больных контрольной группы – pH<1.5. У больных основной группы с декомпенсированным ПДС значения рН составили pH<1.5, у больных контрольной группы значения рН составили также pH<1.5. У 35 больных основной и контрольной группы с компенсированным и субкомпенсированным ПДС во время лечения рН желудочного сока увеличилось вследствие использования более мощных блокаторов секреции желудочного (фамотидин, ранитидин, омепразол) до значений 1.5<pH<2.1 (гиперхлоргидрия с частичной или полной компенсацией кислотонейтрализации). В целом следует отметить, что действие “Омеза” как в дозе 20мг, так и 40мг в сутки было незначительным, по-видимому, из-за низкой биодоступности препарата при язвенном ПДС. После отмены препаратов через 24 часа уровень рН возвращался к исходным значениям pH<1.5.
Доля оперированных больных в основной и контрольной группах представлена в таблице 3.
Таблица 3
Соотношение оперированных больных
| Группы больных | Основная группа | Оперированы | Контрольная группа | Оперированы | Всего | Оперированы |
| Степень стеноза | ||||||
| Компенсированный стеноз | 3 (7%) | --- | 5 (8%) | 1 (20%) | 8 (7%) | 1 (13%) |
| Субкомпенсированный стеноз | 33 (77%) | 30 (90.9%) | 49 (77%) | 46 (93.9%) | 82 (77%) | 76 (93%) |
| Декомпенсированный стеноз | 7 (16%) | 7 (100%) | 10 (15%) | 10 (100%) | 17 (16%) | 17 (100%) |
| Всего | 43 (100%) | 37 (86%) | 64(100%) | 57 (89%) | 107(100%) | 94 (88%) |
Как видно из представленной таблицы, процент оперированных больных в основной и контрольной группах достоверно не отличался (р> 0.01). При анализе таблицы видно, что и в основной и в контрольной группах максимальная доля оперированных больных приходится на пациентов с декомпенсированным ПДС (100% пациентов), минимальная доля оперированных больных приходится на пациентов с компенсированным ПДС (0% и 20% соответственно в основной и контрольной группах), в случае субкомпенсированного ПДС доля оперированных больных составила соответственно 90.9% и 93.9% в основной и контрольной группе.
Из 3 больных с компенсированным ПДС в основной группе никто не был оперирован. У двух больных в результате консервативного лечения, включавшего и лечебную эндоскопию, явления пилородуоденального стеноза были разрешены. Один пациент с редукцией стеноза отказался от оперативного лечения. Один больной из контрольной группы был оперирован. На операции у больного - желудок обычных размеров, стенки не гипертрофированны. В пилородуоденальной зоне определялась язва. Отек, гиперемия тканей. Воспалительный инфильтрат суживал просвет пилорического канала до 12 мм. Перигастрит, перидуоденит. У 4-х пациентов контрольной группы наступила компенсация клинических проявлений ПДС и они были выписаны для амбулаторного наблюдения и лечения.
Из 33 больных основной группы с субкомпенсированным ПДС 30 были оперированы без летальных исходов. Один больной отказался от операции. Два пациента с наступившей компенсацией ПДС были выписаны для динамического наблюдения и амбулаторного лечения с рекомендацией проведения лечебной эндоскопии. На операции На операции у 27 больных обнаружены следующие изменения: желудок обычных размеров, стенки умеренно гипертрофированны. В области пилоробульбарного отдела определялась рубцово-язвенная деформация, выражен перипроцесс, суживающий выход из желудка в среднем до 10+1.4 мм. Определялся язвенный рубец- картина субкомпенсированного пилородуоденального стеноза, у 3 больных основной группы обнаружены следующие изменения: желудок обычных размеров, стенки не гипертрофированны. В пилородуоденальной зоне определялась язва. Отек, гиперемия тканей. Воспалительный инфильтрат суживал просвет пилорического канала в среднем до 12+1.7мм. Перигастрит, перидуоденит- картина компенсированного пилородуоденального стеноза..
В контрольной группе из 49 больных с субкомпенсированным ПДС 46 были оперированы. Из них 1 умер в 1-е сутки после операции от инфаркта миокарда, 1 больной умер на 5-е сутки после операции - тромбоэмболия легочной артерии, у 1-го пациента развилась пневмония. На операции у 46 больных обнаружены следующие изменения: желудок эктазирован, стенки умеренно гипертрофированны. В области пилоробульбарного отдела определялась рубцово-язвенная деформация, выражен перипроцесс, суживающий выход из желудка до 9+1.7 мм. Определялся язвенный рубец- картина субкомпенсированного пилородуоденального стеноза. Трое больных контрольной группы после клинико-эндоскопической реабилитации от дальнейшего лечения отказались и были выписаны с рекомендацией динамического наблюдения.
Из 7 больных основной группы с декомпенсированным ПДС 7 больных были оперированы. Один больной умер на 2 день после операции - тромбоэмболия легочной артерии и один - на 3-е сутки после операции (инфаркт миокарда). На операции у 7 больных желудок эктазирован, стенки гипертрофированны, реже истончены. Пилоробульбарный отдел резко деформирован. Перигастрит, перидуоденит. После разделения спаек рубцовая деформация сохранялась. Определялось сужение просвета пилорического канала в среднем до 6+1.9 мм.
Все 10 больных контрольной группы с декомпенсированным ПДС были оперированы. Два пациента умерли в течение 1-х суток после операции - инфаркт миокарда, один - на 4-е стуки после операции (тромбоэмболия легочной артерии). У 1-го больного после операции развилось ОНМК и ему было назначено специализированное лечение. У 1-го больного развилась несостоятельность анастомоза. Он был реоперирован. Выписан в удовлетворительном состоянии. На операции у 10 больных желудок эктазирован, стенки гипертрофированны, реже истончены. Пилоробульбарный отдел резко деформирован. Перигастрит, перидуоденит. После разделения спаек рубцовая деформация сохранялась. Определялось сужение просвета пилорического канала в среднем до 6+1.7 мм.
Всего среди пациентов основной группы оперировано 86% больных. Средний возраст оперированных составил 64,3+1,3 года. Резекция желудка по Ру выполнена 3-м больным, по Бальфуру - 3-м больным, по Бильрот 1 - 7 больным, операция Жабулэ - 3 больным, Бильрот 2- 19-ти больным, пилоропластика с СПВ-1 больному, гастроэнтероанастомоз со стволовой ваготомией- 1 больному (операции проводились в среднем на 8-й +2 день, средний возраст не оперированных больных составил 49,9+ 1,5 лет).
Среди пациентов контрольной группы оперировано 89% больных. Средний возраст оперированных составил 63+ 1,4 года (1 – компенсированный стеноз 10- декомпенсированный стеноз, 46 - стеноз субкомпенсированный). Резекция желудка по Бильрот 1 выполнена 14-и больным, по Бильрот 2 - 29-ти больным, по Бальфуру - 4 -м больным, по Ру - 2-м больным, иссечение язвы - 2 больным, гастродуоденоанастомоз по Жабулэ - 4 больным, пилородуоденопластика со стволовой ВТ- 1 больному, гастроэнтероанастомоз со стволовой ВТ - 1-му больному (операции проводились в среднем на 19-й + 3 день). Перед выполнением органосохраняющих операций больным проводили атропиновый и гистаминовый тесты с последующим проведением внутрижелудочной рН-хромоскопии. Во время операции проводили гистаминовый тест с проведением внутрижелудочной рН-хромоскопии для контроля полноты ВТ.
Данные о послеоперационной летальности в основной и контрольной группах больных представлены в таблице 4.
Таблица 4
Послеоперационная летальность в основной и контрольной группах больных .
| Группы больных | Основная группа(1)(N=2) | Контрольная группа(2)(N = 5) | Достоверность различий - p (1-2) |
| Послеоперационная летальность в % | 5.4% | 8.8% | p < 0.001 |
Как видно из таблицы послеоперационная летальность была выше у больных контрольной группы (8.8%), чем у больных основной группы (5.4%). Относительный риск равен 0.61, снижение относительного риска составляет 60%, что говорит о клинической эффективности предложенного метода лечения. Причинами послеоперационной летальности в основной и контрольной группах были:1) -острый инфаркт миокарда (2.97% и 5.26% больных соответственно) и 2) -тромбоэмболия легочной артерии (2.97% и 3.5% больных соответственно).
Виды послеоперационных осложнений у больных основной и контрольной групп представлены в таблице 5.
Таблица 5
Характеристика послеоперационных осложнений у больных основной и контрольной групп
| Группы больных | Основная группа(1) | Контрольная группа (2) | Достоверностьразличий P(1-2) |
| Вид осложнений | |||
| Тромбоэмболия легочной артерии | 2.7%летальные исходы | 3.5%летальные исходы | p > 0.01 |
| Острый инфаркт миокарда | 2.7%летальные исходы | 5.26%летальные исходы | p > 0.01 |
| Пневмония | 0% | 1.75% | |
| ОНМК | 0% | 1.75% | |
| Несостоятельность анастомоза | 0% | 1.75% | |
| Всего осложнений | 5.4% | 14.01% | P < 0.01 |
По количеству осложнений в основной группе больных было достоверно меньше осложнений – 5.4%, чем у больных контрольной группы – 14.01%. Относительный риск равен 0.39, снижение относительного риска составляет 75%. Число осложнений, связанных с ОНМК составило 0% и 1.75% соответственно в основной и контрольной группах. Доля послеоперационной пневмонии составила 0% и 1.75% соответственно в основной и контрольной группах. Несостоятельность анастомоза была выявлена у 1.75% больных контрольной группы.
Диаграмма 1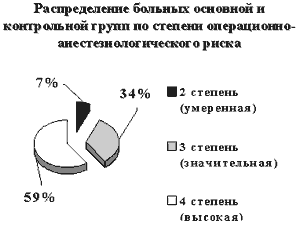 |
На диаграмме 1 отражена степень ОАР перед операцией у больных основной и контрольной групп. Из рисунка видно, что снизилась доля больных с крайне высокой и высокой степенью ОАР и возросла численность больных с умеренной степенью ОАР, однако в основной группе срок снижения степени ОАР составил 9+1.2, а в контрольной – 14+1.3 дней (p<0.01). |
Средний срок лечения оперированных больных в основной группе был достоверно меньше (22.6+1.5 дней), чем у больных контрольной группы (28.7+1.3 дней) (p<0.01). В основной группе на 3-й день лечения удавалось достичь положительного азотистого баланса (+2г), в то время как в контрольной группе азотистый баланса был на уровне –1г.
Научная новизна работы
На основании современных диагностических методов исследования определена важная роль моторно-эвакуаторных нарушений и болевого синдрома в динамике клинической картины язвенного пилородуоденального стеноза. На современном этапе купированию болевого синдрома придается важное значение, так как боль – не только симптом большинства острых и хронических заболеваний, но и сложный психофизиологический феномен, вовлекающий механизмы регуляции и формирования эмоций, моторные, гуморальные и гемодинамические проявления [30].
Впервые показана возможность эффективной ликвидации моторно-эвакуаторных нарушений и болевого синдрома у больных с язвенным пилородуоденальным стенозом посредством применения капиллярного лечебного зонда. Лечебное воздействие зонда связано, по-видимому, с его нейрорефлекторным влиянием на зоны водителей ритма желудка и двенадцатиперстной кишки [31, 32, 33, 34] и разрывом “порочного” круга, возникающего при язвенной болезни (язвенный дефект, болевой синдром, моторно-эвакуаторные нарушения, нарушения микроциркуляции в зоне язвенного дефекта).
Разработанная лечебная тактика у больных с язвенным пилородуоденальным стенозом позволяет уменьшить тяжесть метаболических нарушений, нормализовать водно-электролитный баланс, что ведет к снижению степени операционно-анестезиологического риска и обеспечивает возможность проведения оперативного вмешательства в плановом или отсроченном порядке.
Практическое значение работы.
Применение капиллярного лечебного зонда в комплексной предоперационной подготовке больных с язвенным пилородуоденальным стенозом позволяет устранить в достоверно более короткие сроки абдоминальный болевой синдром, корригировать моторно-эвакуаторные и метаболические нарушения, показатели питательного статуса, сократить сроки рубцевания язвенных дефектов. У больных с функциональным язвенным пилородуоденальным стенозом использование капиллярного лечебного зонда позволяет ликвидировать проявления стеноза. Проведение предоперационной подготовки с использованием капиллярного лечебного зонда позволяет снизить степень операционно-анестезиологического риска, послеоперационную летальность и количество послеоперационных осложнений у больных с язвенным стенозом.
Выводы:
- Использование капиллярного лечебного зонда в комплексе предоперационной подготовки больных с язвенным пилородуоденальным стенозом снижает сроки ликвидации болевого синдрома, рубцевания язвенных дефектов, позволяет корригировать моторику желудка и нарушения питательного статуса.
- Использование капиллярного лечебного зонда не влияет на кислотопродуцирующую функцию желудка.
- Разработанный нами алгоритм лечебной тактики ведения больных с язвенным пилородуоденальным стенозом включает в себя три этапа:
- Использование капиллярного лечебного зонда по разработанной нами схеме является эффективным способом комплексной предоперационной подготовки больных с язвенным пилородуоденальным стенозом, позволяющим снизить степень операционно-анестезиологического риска.
- Применение капиллярного лечебного зонда при предоперационной подготовке больных язвенной болезнью, осложненной пилородуоденальным стенозом, с высокой степенью операционно-анестезиологическим риском позволяет уменьшить послеоперационную летальность c 8.8% до 5.4%, а количество послеоперационных осложнений с 14.01% до 5.4%.
I этап - энтеральное зондовое питание 5-7 дней через капиллярный лечебный зонд.
II этап: А – энтеральное зондовое питание не проводится, а капиллярный лечебный зонд сохраняется для транзитной поддержки химуса в сочетании с диетотерапией и противоязвенной фармакотерапией у больных с суб- и декомпенсированным стенозом, а также компенсированным стенозом с выраженным стойким абдоминальным болевым синдромом - 10-14 дней
Б - оперативное лечение у больных с органическим компенсированным, субкомпенсированным и декомпенсированным пилородуоденальным стенозом после коррекции белково-энергетической недостаточности и нарушений гомеостаза
III этап - лечебная эндоскопия у больных с замедленной репарацией в зоне язвенного дефекта (2 раза в неделю 10-14 дней).
Практические рекомендации
- Капиллярный лечебный зонд целесообразно устанавливать в течение первых суток и начинать энтеральное зондовое питание через просвет катетера сбалансированными белковыми смесями типа “Изокал”, “Оволакт” в течение 5-7 дней. Объем растворов для питания необходимо определять в зависимости от степени белково-энергетической недостаточности.
- После оценки тяжести состояния больного для коррекции выраженных водно-электролитных нарушений и белково-энергетической недостаточности целесообразно назначить инфузионную парентеральную терапию в первые сутки после поступления.
- При отсутствии выраженных моторно-эвакуаторных нарушений и абдоминального болевого синдрома больному дополнительно к энтеральному зондовому питанию можно разрешить прием диетической пищи per os (стол 1 по Певзнеру).
- Проведение контрольного радионуклидного и рентгенологического исследований на 6-8 сутки на фоне присутствия капиллярного лечебного зонда позволит решить вопрос о характере пилородуоденального стеноза – функциональный он или органический.
- В случае функционального характера пилородуоденального стеноза следует продлить присутствие капиллярного лечебного зонда на фоне перорального диетического питания (стол 1 по Певзнеру) и противоязвенной терапии на срок до трех недель для достижения полного рубцевания язвенных дефектов и ликвидации моторно-эвакуаторных нарушений. При замедленной репарации в зоне язвенных дефектов проводить сеансы лечебной эндоскопии 2 раза в неделю 10-14 дней.
- Оперативное лечение необходимо проводить больным с органическим пилородуоденальным стенозом после коррекции белково-энергетической недостаточности и нарушений гомеостаза. Оперативное вмешательство целесообразно проводить в плановом или отсроченном порядке по мере снижения степени операционно-анестезиологического риска.
Список сокращений
ДПК – двенадцатиперстная кишка
ИБС – ишемическая болезнь сердца
КЛЗ – капиллярный лечебный зонд
МЭН – моторно-эвакуаторные нарушения
ОАР – операционно-анестезиологический риск
ОНМК – острая недостаточность мозгового кровообращения
ПДС – пилородуоденальный стеноз
РФП – радиофармпрепарат
ЭЗП – энтеральное зондовое питание
ЯБ – язвенная болезнь
ЯБДПК – язвенная болезнь двенадцатиперстной кишки
ЯБЖ – язвенная болезнь желудка
Авторы:
Стоногин Сергей Васильевич – хирург инфекционного корпуса Тушинской детской городской больницы, кандидат медицинских наук
143406 Красногорск, Железнодорожная 28А 24
e-mail: svаs70@mаil.ru
Шерцингер Александр Георгиевич – доктор медицинских наук, профессор отдела экстренной хирургии Научного центра хирургии РАМН
Тимен Леонид Яковлевич – подполковник медицинской службы, член Американской академии медицинских наук, член американской академии наук, врач-эндоскопист 20-й городской клинической больницы г. Москвы раб.
Тел. 471-33-62.
Черепанин Андрей Игоревич – кандидат медицинских наук, доцент кафедры хирургических болезней N2 Московской медицинской академии имени И.М. Сеченова, раб.
Тел. 471-11-35.
Литература
- Гринберг А.А., Затевахин И.И., Щеголев А.А. Хирургическая тактика при язвенных гастродуоденальных кровотечениях // 1996, Москва, 149 стр.
- Cuttat J.F., Ruchat P., Chapuis G. Gastroduodenal ulcer disease: what surgical indications are left ? // Schweiz Med Wochenschr 1989 May 27; 119 (21): 729-730.
- Nyhus L.M. Current operations for duodenal ulcer // Jpn J Surg 1977 Sep; 7 (3): 105 - 113.
- Гринберг А.А. Стратегия и тактика лечения язв двенадцатиперстной кишки и желудка // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. Приложение 4, Материалы 3-й Российской гастроэнтерологической недели,15-21 ноября 1997 г ., Москва , N5, 7 том стр.21.
- Вахидов В.В., Калиш Ю. И., Хачиев Г.Л. Особенности течения язвенной болезни желудка и двенадцатиперстной кишки и ее хирургическое лечение у лиц пожилого возраста // Хирургия , 1990, N 7, стр. 7 - 13.
- Попова Т.С., Тамазашвили Т.Ш., Шестопалов А.Е. Парентеральное и энтеральное питание в хирургии // Москва , 1996, 221 стр.
- Скатин Л.И., Чирков Ю.В. Анализ летальности в плановой хирургии язвенной болезни // Вестн. Хир. 1992 ,N3, стр. 352-355.
- Lauven P.M. , Stoeckel H., Ebeling B.J. Perioperative morbidity and mortality of geriatric patients . A retrospective study of 3905 cases // Anasth Intensivther Notfallmed 1990 Jan ; 25 Suppl 1: 3 - 9.
- Szauer J.S., Zukaukas C. The problems of abdominal operations in eldery patients // Geriatrics 1975 , Sep ;30(9): 57 - 59, 63 - 64 .
- Кузин Н.М., Крылов Н.Н. Выбор метода лечения дуоденальной язвы и ее осложнений на основании показателей качества жизни // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. Приложение 4, Материалы 3-й Российской гастроэнтерологической недели, 15-21 ноября 1997 г., Москва, N5, 7 том,стр. 83.
- Chau S.W., Yu K.L., Yip W.H., Tseng C.K. The safety of geriatric anaesthesia // Ma Tsui Hsueh Tsa Chi 1992, Dec; 30 (4) : 211 - 221.
- Zuccala G., Cochi A., Gambassi G., Bernabei R., Carbonin P. Postsurgical complications in older patients. The role of pharmacological intervention // Drugs Aging1994, Dec; 5(6): 419-430.
- Тимен Л.Я. рН-хромоскопия в оценке функционального состояния пищевода, желудка и двенадцатиперстной кишки // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 1996, N 4, том 6, стр. 280.
- Тимен Л.Я., Кручинин Е.З., Савин Ю.Н., Волков А.В. Значение хромоскопии в оценке функционального состояния желудка и двенадцатиперстной кишки // Военно- мед. Журнал, 1984, N 12, стр. 53 - 54.
- Тимен Л.Я. Клинико-эндоскопическое обоснование патогенетического механизма лечебного воздействия гастроинтестинального зонда в терапии язвенной болезни желудка и двенадцатиперстной кишки // Медицинская консультация, 1993, N1,стр.21- 22.
- Полуэктов В.Л. Опыт эндоскопической вентрикулопунктуры // Вестник медицины, 1995, N1, стр. 10.
- Kelly K.A., Code C.F., Elveback L.R. Patterns of canine gastric electrical activity // Amer. J. Physiol. 1969, v.217, p.461-470.
- Конден Р., Найхус Л. Клиническая хирургия // Москва, "Практика" 1998, стр. 344-353, 416-428.
- Тимен Л.Я., Черепанин А.И., Стоногин С.В. К вопросу о патогенезе язвенной болезни. Новый подход к лечению симптоматических гастродуоденальных язв // Медицинская консультация, Москва, 1995, N 2 (6) , стр. 51 - 54.
- Тимен Л.Я., Сидоренко Т.П., Черепанин А.И., Тюрникова И.С., Жигалова С.Б., Дасаев Ю.А., Кручинин Е.З., Барулина Т.И. Лечение язвенной болезни желудка и двенадцатиперстной кишки с использованием гастроинтестинального лечебного зонда в поликлинической практике (предварительное сообщение) // Медицинская консультация, 1994, N 3, стр. 46 - 47.
- Тимен Л.Я., Хаит Б.А., Черепанин А.И., Стоногин С.В. Лечение язвенных гастродуоденальных кровотечений у пациентов с высокой степенью операционного риска // Российский журнал гастроэнтерологии, гепатологии, колопроктологии.1996, N 4, том 6, стр. 280 - 281.
- Тимен Л.Я., Черепанин А.И., Стоногин С.В. Механизмы лечебного воздействия энтерального зондового питания на течение язвенной болезни желудка и двенадцатиперстной кишки // Российский журнал гастроэнтерологии, гепатологии, колопроктологии, 1996, приложение N 2, N 4, том 6, стр. 69 .Приложение N 2.
- Тимен Л.Я., Шерцингер А.Г., Черепанин А.И., Стоногин С.В. Новые медицинские технологии в лечении язвенной болезни желудка и двенадцатиперстной кишки в стационаре и амбулаторных условиях // Проблемы городского здравоохранения, Санкт - Петербург, 1995, выпуск 1, стр.182 - 186.
- Тимен Л.Я., Шерцингер А.Г., Черепанин А.И., Стоногин С.В. Гастроинтестинальный зонд в лечении язвенной болезни желудка и двенадцатиперстной кишки // 1996, Российский журнал гастроэнтерологии, гепатологии, колопроктологии, N 4, том 6, стр. 281.
- Тимен Л.Я., Шерцингер А.Г., Сидоренко Т.П., Черепанин А.И., Жигалова С.Б., Стоногин С.В. Применение гастроинтестинального зонда и лечебной эндоскопии у больных с симптоматическими гигантскими язвами // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. Приложение 4, Материалы 3-й Российской гастроэнтерологической недели, 15-21 ноября 1997 г., Москва, N5, 7 том стр. 283.
- Тимен Л.Я., Шерцингер А.Г., Сидоренко Т.П., Черепанин А.И., Жигалова С.Б., Стоногин С.В., Евдокимов А.Э., Тильман Н.М. Капиллярный гастроинтестинальный лечебный зонд в клинико-эндоскопической практике // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. Приложение 4, Материалы 3-й Российской гастроэнтерологической недели, 15-21 ноября 1997 г., Москва , N5, 7 том стр. 284.
- Новиков В.Ф. Эффективность метиленового синего в лечении гастродуоденальных язв // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. Приложение 4, Материалы 3-й Российской гастроэнтерологической недели, 15-21 ноября 1997 г ., Москва , N5, 7 том стр. 274.
- Гребенев А.Л. Руководство по гастроэнтерологии // 1996, Т 2 , с. 710 .
- Шептулин А.А. Базисная лекарственная терапия язвенной болезни // Русский медицинский журнал 1998, N 7 том 6 стр. 412 - 417.
- Михайлович В.А., Игнатов Ю.Д. Болевой синдром // Ленинград, "Медицина", 1990 г.
- Daniel E.E., Berezin I. Interstitial cells of Cajal: are they mayor players in control of gastrointestinal motility? // J. Gastrointest. Mot. 4: 1-24, 1992.
- Huizinga J.D., Thuneberg L., Kluppel M. W/kit gene required for interstitial cells of Cajal and for intestinal pacemaking activity // Nature 373: 347-349, 1995.
- Despopoulos A., Silbernagl S. Color atlas of physiology // 1986, Georg Thieme Verlag Stuttgart, New York.
- Чадвик В.С., Филлипс С.Ф. Гастроэнтерология // Москва, "Медицина", 1985, Том 1,2,3.