Витрификация человеческого эмбриона в продвинутой стадии развития
|
Введение
В лечении бесплодия использование глубокого замораживания эмбрионов широко распространено. Криоконсервация считается приемлемым решением для сохранения лишних эмбрионов, образующихся в ходе ЭКО, для последующей имплантации и уменьшения опасности многоплодной беременности. При низких температурах эмбрионы сохраняются в жизнеспособном состоянии, и их метаболическая активность не нарушается. Существует два основных способа глубокого замораживания эмбрионов: 1. Метод контролируемой медленной криоконсервации (постепенная криоконсервация), которую ввел в 1971 Whittingam; 2. Несбалансированная криоконсервация с а) ультрабыстрой криоконсервацией и б) витрификацией, которая была разработана в 1985 г. Rall и Fahy на эмбрионах мышей. I. Контролируемая медленная криоконсервация является в настоящее время обычным методом консервации человеческих эмбрионов. Их охлаждают медленно, чтобы произошла дегидратация клеток, и уменьшилось образование больших внутриклеточных кристаллов льда. Криопротекторы осмотически «вытягивают» из клетки воду, которая замерзает в межклеточном пространстве. Клетка не может быть дегидратирована очень сильно, без повреждения эмбриона внутриклеточным осмотическим давлением. Чтобы предотвратить дегидратацию, добавляют растворы, непроникающие внутрь эмбриона (например сахарозы). При медленном охлаждении клетка остается в равновесии с замерзшим раствором и при этом дегидрируется. Существует опасность повреждения эмбриона из-за межклеточной и внутриклеточной кристаллизации, если клетки охлаждаются слишком быстро. Кроме того, растущая концентрация межклеточного раствора может вызвать токсическое повреждение эмбриона. Для медленной криоконсервации необходимы дорогостоящие приборы, значительную роль играет фактор времени. II(а). При ультрабыстрых методах замораживания эмбрионы, находящиеся в растворе 3,5–4,5 М DMSO (диметилсульфоксид) и 0,25–0,5 М сахарозы, помещают в жидкий азот. При этом образуются мелкие кристаллы льда, менее стабильные, чем большие тающие при более низких температурах; при медленном оттаивании возможна их агрегация в большие кристаллы. II(б). При витрификации значительно упрощается не только процесс охлаждения, исключается опасность физических и химических повреждений, вызванных межклеточной и внутриклеточной кристаллизацией. Под витрификацией понимают переход жидкости в твердое состояние, который вызван не кристаллизацией, а экстремальным повышением вязкости во время охлаждения. Витрификационная жидкость состоит из смеси высококонцентрированного проникающего криопротектора (DMSO, ацетамид, пропиленгликоль, глицерол, этиленгликоль) и непроникающего криопротектора (полиэтиленгликоль, фиколл, сахароза) в буферном солевом растворе. Концентрация криопротектора так высока, что при очень быстром охлаждении до –196°С вязкость сильно увеличивается. Цель исследования выяснить применим ли метод витрификации на человеческих эмбрионах. Нами были проанализированы влияние стадии развития, дальнейшее развитие эмбриона после оттаивания, а также частота имплантации после витрификации и оттаивания. Материал и методы Для проверки токсичности проведены наблюдения за выживаемостью после витрификации и оттаивания морул/бластоцист после оплодотворения патологического с образованием одного или трех пронуклеусов. Данные эмбрионы были получены после культивирования in vitro аномально (одно- или трех-пронуклеарно) оплодотворенных яйцеклеток. Также были использованы эмбрионы плохого качества. После этого культивировали часть морфологически нормальные двухдневные эмбрионы в среде S2 (Scandinavian IVF Science AB) до возраста 4–6 дней. Морулы/бластоцисты были криоконсервированы методом витрификации и после оттаивания перенесены пациенткам. Витрификация проводилась по методу Махмудзадеха в 2 этапа. Все растворы были основаны на PBS - HSA (солевой раствор фосфатного буфера с человеческим сывороточным альбумином). Выбранные эмбрионы были эквилибрированы при комнатной температуре в 20% (v/v) этиленгликоле (=EG 20) в течение трех минут. Затем их поместили во второй раствор, который состоял из 40% (v/v) этиленгликоля, 18% (w/v) фикола и 0,3М сахарозы (EFS). После краткой экспозиции в этом растворе эмбрионы поместили в соломинку 0,25 мл. Соломинка была сначала заполнена примерно на 3,5 см 0,5М раствора сахарозы, затем следовал слой воздуха толщиной около 9 мм и примерно 2,5 см EFS, в котором находились эмбрионы. Затем снова следовал слой воздуха толщиной около 9 мм и соломинка была заполнена до конца 0,5М раствора сахарозы, закупорена порошком и сразу же помещена в жидкий азот (соломинка изображена на рис. 1). Рис. 1. Соломинка после заполнения.
Время между переносом эмбрионов в раствор EFS и помещением в жидком азоте выдерживалось как можно меньше (максимально 60 с.). Эмбрионы оттаивали на водяной бане при 40°С в течение 10 с, после чего содержимое соломинки выливалось в раствор 0,25 М сахарозы. После 3 мин эквилибрирации витрификационный раствор удаляли путем промывания эмбрионов в среде S2. Дальнейшее культивирование in vitro для наблюдений или последующего выполнения ПЭ проводилось также в среде S2. Таблица 1. Тест на токсичность: выживаемость in vitro аномально оплодотворенных человеческих морул и бластоцист после эквилибрирации (3 мин в EG 20 и 1 мин в EFS)
Результаты В табл. 1 обобщены результаты испытаний на токсичность витрификационного раствора человеческих аномально оплодотворенных эмбрионов, находящихся на стадии морулы или бластоцисты. Из 7 морул и 5 бластоцист все эмбрионы (100%) обнаружили после витрификации и оттаивания более чем 80% интактных бластомеров. 3 из 7 морул развились далее в бластоцисты (43%), 2 развились в экспандированные бластоцисты (29%). Одна из 5 бластоцист осталась в стадии ранней бластоцисты (20%), 3 из 5 достигли стадии экспандированной бластоцисты (60%). Выживаемость in vitro человеческих эмбрионов плохого качества после двухэтапной витрификации представлена в табл. 2. Таблица 2. Выживаемость in vitro витрифицированных человеческих эмбрионов плохого качества после двухэтапной витрификации (3 мин в EG 20 и 1 мин в EFS)
Из 8 витрифицированных морул выжили 50% (4) с более чем 80% интактных бластомеров, 38% (3) показали более чем 50% интактных бластомеров. 2 из этих 7 (29%) морул развились в бластоцисты и 2 из 7 (29%) в экспандированные бластоцисты. Из 7 витрифицированных бластоцист выжили 57% (4) с более чем 80% интактными бластомерами, 29% (2) показали более чем 50% интактных бластомеров. 2 из 6 бластоцист (33%) остались в стадии бластоцисты, и 2 из 6 (33%) развились в экспандированные бластоцисты. Таблица 3. Выживаемость in vitro витрифицированных человеческих эмбрионов после двухэтапной витрификации (3 мин в EG 20 и 1 мин в EFS)
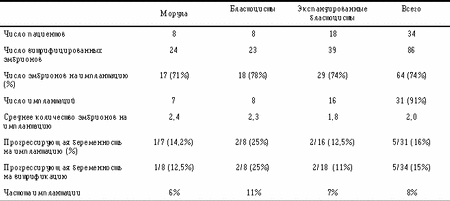
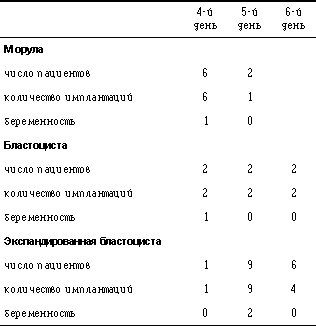
На 34 пациента (табл. 3) было витрифицировано 86 эмбрионов (24 в стадии морулы, 23 в стадии бластоцисты и 39 в стадии экспандированной бластоцисты). После оттаивания для переноса в нашем распоряжении было всего 64 (74%) эмбриона. ПЭ был выполнен у 91% пациентов. В результате была зафиксирована прогрессирующая беременность в 15% на витрификацию/пациента и 16% на имплантацию/пациента. Наиболее высокая частота наступления беременности была достигнута при переносе ранних бластоцист. Частота беременности по отношению к дню витрификации показана в табл. 4. Если эмбрионы были витрифицированы на стадии морулы, то беременность развивалась только у тех эмбрионов, которые были в возрасте 4 дней стадии морулы. Тоже самое можно было наблюдать с бластоцистами. Если эмбрионы отставали в своем развитии, беременность не наступала. Имплантация 5-дневных эмбрионов, которые были в стадии экспандированной бластоцисты, привела к одной беременности, но, однако, этого не случилось с эмбрионами, достигшими стадии бластоцисты на 4-й или 6-й день. Таблица 4. Частота беременности в зависимости от дня витрификации
Дискуссия Витрификация облегчает и упрощает процесс замораживания эмбрионов. Преимущество этого метода в том, что эмбрионы повреждаются кристаллами льда, как это происходит при контролируемой медленной криоконсервации. Единственный недостаток витрификации — химическая токсичность, которая прямо коррелирует с концентрацией криопротектора, временем и температурой экспозиции эмбриона в этом растворе. Коэффициент проницаемости находится в прямой связи с молекулярным весом и является мерой скорости проникновения криопротектора в эмбрион или, наоборот, выхода из него. Низкий молекулярный вес является преимуществом, так как криопротектор показывает более высокую скорость попадания внутрь и выхода из эмбриона. Таким образом индуцируется меньшая химическая интоксикация, так как время экспозиции эмбриона в витрификационном растворе может быть сокращено. Витрификационный раствор, который содержит этиленгликоль, менее токсичен, чем 1,2-пропандиол. В опытах с мышами Kasai оптимизировал витрификационный метод, в котором использовались 40% этиленгликоля, 30% фикола и 0,5М сахарозы. Massip и др. [12] отмечают необходимость провести эквилибрирацию при более низкой концентрации криопротектора (EG 20), и только после этого экспозицию в течение короткого времени при более высокой концентрации (EFS). Таким образом, уменьшается токсичность и используется меньшая концентрация, которая может вызвать «образование льда». Результаты наших предварительных исследований (см. табл. 1) подтверждают, что этот витрификационный раствор имеет низкую токсичность. Витрификация применяется к полученным in vitro морулам/бластоцистам, так как традиционные методы криоконсервации на этих эмбрионах не дают удовлетворительных результатов по сравнению с эмбрионами, развивавшимися in vivo в опытах с животными. Методы, которые применялись по отношению к эмбрионам, образовавшимся in vivo, были адаптированы для созданных in vitro эмбрионов. При этом оказалось, что данные эмбрионы были значительно чувствительнее по отношению к процессу криоконсервации. Повышенной чувствительности полученных in vitro эмбрионов к повреждениям из-за охлаждения можно избежать, используя достаточно быструю скорость охлаждения. Эмбрионы, полученные in vitro и находящиеся на продвинутой стадии развития, обладают более высокой устойчивостью к витрификации, чем эмбрионы, находящиеся на более ранних стадиях развития. Наши результаты, представленные в табл. 2 и 3, подтвердили эти опыты. Потенциал развития бластоцист in vitro меньше, поэтому было заморожено меньше бластоцист, уровень выживаемости и частота наступления беременности для бластоцист выше. Как видно из результатов, частота наступления беременности после витрификации составляет в среднем 16% на пациентку, уровень выживаемости и дальнейшее развитие витрифицированных человеческих эмбрионов (см. табл. 2) являются приемлемыми. Для бластоцист была достигнута наивысшая (25%) частота наступления беременности (см. табл. 3). Темпы дробления, а именно скорость развития эмбрионов до стадии морулы или бластоцисты оказывает значительное влияние на уровень выживаемости и уровень беременности. Подтверждением этому служат наши результаты (см. табл. 4). Эмбрионы, которые достигли стадии морулы/бластоцисты на 4-й день, приводили к беременности в каждом случае. Также и с экспандированными бластоцистами, которые достигли зрелости уже на 5-й день, было достигнуто 2 беременности. Для эмбрионов с более замедленными темпами развития было невозможно достичь имплантации. Это подтверждает наблюдение Massip и соавт., что отстающие в своем развитии эмбрионы хуже поддаются криоконсервации. Определение «развитие» базируется в наших результатах исключительно на оценках бластомеров с помощью светового микроскопа. Задача дальнейших исследований состоит в том, чтобы точнее определить потенциал развития и, например, использовать в качестве индикаторов различные модели протеинов. Преимущества витрификации состоят в том, что уровень выживаемости для in vivo и in vitro полученных эмбрионов является приемлемым, что показывают и наши результаты (см. табл. 3–4). Потенциальная опасность повреждений из-за образования кристаллов льда в суспензии исключена. Витрификация представляет собой более быстрый способ, чем традиционные методы, к тому же здесь не нужно дорогое компьютеризированное оборудование. Недостатки витрификации состоят в химической токсикации. Конечно, повреждения из-за эффекта охлаждения в традиционных медленных методах вероятно сильнее, чем химическая токсикация витрификационного раствора. Длительная in vitro культура эмбрионов до стадии морулы или бластоцисты может сократить способность эмбрионов к развитию. Чтобы усовершенствовать эту технику, необходимо улучшение культуральных систем для продвинутых стадий развития эмбриона (например, с помощью использования со-культур). Необходимо использование метода витрификации на ранних стадиях развития, для сокращения времени содержания культуры in vitro. A. Stecher*, P. Vaderzwalmen**, I. Riedler*, N. Zech*, H. Zech* Institute fur Reproduktionsmedizin und Endokrinologie, Austria*; SIMAF, Belgien** |