О критериях назначения хорионического гонадотропина при контролируемой индукции суперовуляции
|
Правильный выбор момента введения хорионического гонадотропина (ХГ) на завершающем этапе индукции суперовуляции (ИС) является одним из важных условий, влияющих на исход ЭКО.
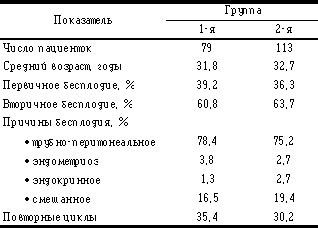
До настоящего времени решение о введении ХГ принималось на основании результатов гормонального и ультразвукового мониторинга. Общепризнанным ультразвуковым критерием назначения ХГ считается размер лидирующего фолликула. Однако в литературе, в том числе и в самых последних публикациях, нет единства взглядов на критические значения этого параметра. Ряд авторов ориентируются на размер одного лидирующего фолликула [3, 12, 21, 29], другие — на группу из 2—3 фолликулов [18, 22, 25]. Величина диаметра этих фолликулов варьирует от 14—15 до 20 мм и более [1, 20, 26]. Выбор тех или иных значений этого критерия чаще всего никак не обосновывается. Нам не удалось найти каких-либо сведений о необходимости дифференцированного подхода к его величине при различных видах ИС. Однако, например, при контролируемой стимуляции суперовуляции (КСС) на фоне десенситизации гипофиза с помощью а-ГнРГ в отличие от схемы кломифенцитрат + человеческий менопаузальный гонадотропин (КЦ+чМГ) отсутствует опасность спонтанной овуляции, а значит возникают условия, которые нельзя не учитывать при выборе времени введения ХГ. В гормональном мониторинге момент назначения ХГ определяется по концентрации эстрадиола (Е2) в крови. Данные об информативных значениях этого критерия для назначения ХГ также весьма различны. Одни авторы ориентируются на величины общей концентрации Е2, другие предпочитают пересчитывать ее на один фолликул диаметром 12 — 15 мм [1, 20]. В первом варианте концентрация Е2 варьирует от 188 до 2000 пг/мл [15, 20], при втором — от 225 до 850 пг/мл (9, 21). Столь значительный разброс свидетельствует об ориентировочном характере критерия Е2 и, поэтому он без данных ультразвукового мониторинга не используется для назначения ХГ. По сути оба этих критерия определяют один и тот же параметр — функциональную зрелость фолликулов. Вместе с тем ни данные о размере фолликулов, ни их количестве, ни концентрации Е2 в крови не позволяют оценить качественные изменения в органах и тканях «мишенях», в частности в эндометрии, которые происходят под влиянием функциональной активности яичников. Несмотря на многочисленность факторов, влияющих на имплантацию эмбрионов, все они могут быть сведены в две группы: 1) связанные с качеством эмбриона(ов); 2) связанные с рецептивностью эндометрия, его прегравидной трансформацией [28]. Толщина эндометрия является своеобразным интегральным показателем его готовности к имплантации эмбриона [4], однако несмотря на то, что она легко оценивается в процессе ультразвукового мониторинга, ее до настоящего времени не рассматривают как критерий для определения времени назначения ХГ. Обусловлено это по-видимому, неоднозначностью результатов исследований, связанных с прогностической ценностью толщины эндометрия в программе ЭКО. По данным одних авторов, толщина эндометрия на день назначения ХГ не оказывает влияния на исход ЭКО [5, 11, 14], другие авторы обнаружили позитивную связь между толщиной эндометрия и частотой наступления беременности [8, 13]. Наш первый опыт работы с а-ГнРГ «Золадекс» в ЭКО [2] показал, что при увеличении более чем в 2 раза частоты наступления беременности по сравнению с циклами, проведенными с использованием КЦ+чМГ, среди лабораторных и клинических показателей наиболее выраженные различия были в степени пролиферации эндометрия на день назначения ХГ. В группе Золадекса толщина эндометрия составила 9,1 мм, а в группе КЦ+чМГ — 6,9 мм. Эти наблюдения и противоречивость данных литературы послужили основанием для проведения настоящей работы, цель которой состояла в изучении возможности использования сочетанной оценки двух параметров — толщины эндометрия и размера фолликулов — в качестве критериев для выбора времени назначения ХГ при КСС. Материал и методы Проведен ретроспективный анализ результатов ИС (количественный и качественный состав когорты фолликулов, толщина эндометрия в день назначения ХГ), пункции фолликулов и оплодотворения ооцитов в культуре (количество ооцитов, частота фертилизации и дробления, количество и качество эмбрионов), частоты наступления беременности в двух группах пациенток нашего центра. Группы были составлены в результате случайной выборки среди пациенток, у которых цикл лечения завершился переносом эмбрионов. В 1-ю группу вошли 79 пациенток, получавших стимуляцию суперовуляции КЦ+чМГ (хумегон или пергонал). Показанием к назначению ХГ в этой группе считалось достижение лидирующим фолликулом среднего диаметра 19 мм или 2—3 фолликулами — 17—18 мм. Во 2-й группе было 113 пациенток, у которых применялся так называемый «длинный» протокол КСС с началом введения а-ГнРГ (декапептил Золадекс) на 21-й день цикла, предшествующего лечебному. В критерии назначения ХГ в этой группе мы ввели толщину эндометрия, определив минимальное значение этого показателя равным 9 мм. Размер лидирующих фолликулов не рассматривался как главный параметр, но средний диаметр этих фолликулов должен был быть не менее 17 мм, без ограничения максимальных значений. При этом мы исходили из того, что даже значительное увеличение среднего диаметра фолликулов до 25 мм не оказывает отрицательного влияния на качество ооцитов [20]. Назначение ХГ при крупных фолликулах благоприятно влияет на прогноз ЭКО [23], в то время как частота оплодотворения, дробления и наступления беременности снижается у ооцитов, полученных при пункции мелких (менее 17 мм) фолликулов [7]. Обе группы не имели существенных различий ни по возрасту пациенток, ни по структуре бесплодия, ни по доле повторных циклов ЭКО (табл.1).
Результаты При проведении ИС в исследуемых группах был выявлен ряд особенностей (табл. 2). Во 2-й группе продолжительность стимуляции и количество израсходованных ампул чМГ в расчете на одну пациентку оказались больше, чем соответствующие показатели в 1-й группе.
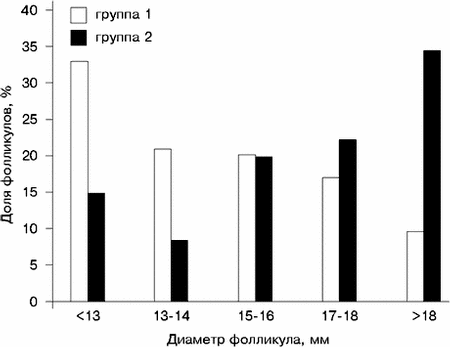
Результаты ИС на день назначения ХГ в исследуемых группах приведены в табл. 3. Во 2-й группе среднее число фолликулов, ооцитов и толщина эндометрия были больше. Доля фолликулов, средний диаметр которых был не менее 17 мм, составила 51% во 2-й группе, 26% — в 1-й группе (p меньше 0,001), доля фолликулов диаметром не менее 19 мм — соответственно 31 и 9% (p меньше 0,001) (см. рисунок).
Частота оплодотворения ооцитов оказалась практически одинаковой в обеих группах. Различия по частоте развития зигот не превышали 5%. Среднее количество эмбрионов во 2-й группе было больше, чем в 1-й группе (табл.4).
Доля эмбрионов с замедленным темпом развития, не достигших к моменту переноса в полость матки стадии 4 бластомеров, оказалась большей в 1-й группе. По остальным, доступным анализу показателям перенесенные в полость матки эмбрионы не имели существенных различий (табл.5).
Примечание. Здесь и в табл. 6: * p меньше 0,05. Во 2-й группе частота наступления беременности, частота многоплодия и развития синдрома гиперстимуляции яичников (СГЯ) были существенно выше, чем в 1-й группе (табл.6).
Распределение фолликулов по диаметру в день назначения ХГ при различных протоколах стимуляции суперовуляции Обсуждение Средняя частота наступления беременности после применения ЭКО по данным последнего мирового регистра, составляет 18,7% в расчете на перенос эмбрионов, [6]. В нашем исследовании этот показатель был близким к среднемировым показателям (16,9%) в 1-й группе (КЦ+чМГ) и значительно превысил его (33,3%) во 2-й группе (КСС). Такой результат свидетельствует о достаточно высоком уровне проведения всех этапов ЭКО в этом исследовании и может рассматриваться как условие, обеспечивающее возможность корректного сравнительного анализа полученных данных. Принципиально важным является ответ на вопрос: «Какие же факторы повлияли на столь значительную разницу в частоте наступления беременности в исследуемых группах?» Возможность повышения эффективности ЭКО в результате КСС хорошо известна и обычно связывается с большим количеством фолликулов, ооцитов и эмбрионов по сравнению со схемой КЦ+чМГ. Однако такой количественный подход не раскрывает механизма, природы наблюдаемого эффекта. Широкое распространение получило мнение, что большее количество эмбрионов позволяет провести качественную селекцию и перенести в полость матки лучшие, наиболее хорошо развивающиеся эмбрионы [10]. Полученные результаты не позволяют подтвердить это положение. Нам не удалось обнаружить существенных различий в большинстве показателей, характеризующих качество переносимых эмбрионов. Исключением была лишь бульшая на 6% в 1-й группе доля эмбрионов с замедленным темпом развития и перенесенных в полость матки на стадии до 4 бластомеров. Однако объяснить этим бульшую в 2 раза частоту наступления беременности во 2-й группе не представляется возможным. Таким образом, по доступным анализу характеристикам перенесенные в полость матки эмбрионы были одинакового качества в обеих группах. Численное преимущество в цепочке фолликулы—ооциты—эмбрионы в конечном итоге свелось к тому, что во 2-й группе после переноса в полость матки остались эмбрионы, которые можно было использовать в программе «криоконсервации эмбрионов». Из всех других влияющих на исход ЭКО параметров значительные различия были обнаружены только в результатах ИС на день назначения ХГ. Большое количество фолликулов при КСС считается следствием воздействия a-ГнРГ на фолликулогенез, которое связывают с блокированием процессов атрезии в когорте индуцированных к развитию и росту фолликулов [15]. Однако бульшая доля крупных фолликулов в когорте 2-й группы явилась прямым следствием принятой нами тактики в отношении критериев назначения ХГ. Основной задачей при проведении КСС во 2-й группе было достижение соблюдения выбранных критериев: толщины эндометрия не менее 9 мм и среднего диаметра лидирующих фолликулов не менее 17 мм. Что между этими критериями не существует строгой прямой зависимости, типичной была ситуация, при которой после достижения желаемой величины одного критерия стимуляцию продолжали, чтобы «подтянуть» показатель второго. В результате средняя толщина эндометрия в этой группе оказалась 10,1 мм, а доля фолликулов средним диаметром 17 мм или более составила 51%. В 1-й группе толщина эндометрия составила 6,8 мм, а доля крупных фолликулов — 26%. Таким образом, достижение необходимой толщины эндометрия произошло с параллельным формированием более крупной по величине и количественному составу когорты фолликулов. Известно, что при нормальном менструальном цикле короткую фазу пролиферации (меньше 11 дней) имеет только 7% женщин, а длинную (больше 20 дней) — 5% женщин [27]. В серии исследований, связанных с подготовкой эндометрия в программах донорства яйцеклеток, было показано, что лучшая рецептивность эндометрия достигается при определенной экспозиции эстрогенового влияния, т.е. продолжительности фазы пролиферации, которая должна составлять 12—19 дней [28]. С этих позиций оптимальная продолжительность фазы пролиферации была получена нами в группе КСС — 15,5 дня, в то время как в группе КЦ+чМГ она была во многих случаях недостаточной и в среднем составила 11,5 дня. В свете приведенных данных можно считать, что значительно большая частота наступления беременности во 2-й группе была обеспечена новым подходом к выбору критериев для определения момента назначения ХГ. В результате нам удалось получить синхронизацию процессов, определяющих исход ЭКО на этом этапе, а именно: хорошее развитие эндометрия и качественную когорту фолликулов. В связи с большим количеством факторов, влияющих на результат ЭКО, оптимальное сочетание этих двух параметров не гарантирует наступление беременности, однако делает ее вероятность существенно выше. Заключение Толщина эндометрия и качественный состав когорты фолликулов являются высокоинформативными ультразвуковыми критериями для принятия решения о завершении КСС и назначении ХГ. В.С. Корсак, Э.В. Исакова, Б.А. Каменецкий, А.А. Кирсанов, О.А. Леонтьева, А.А. Полянин НИИ акушерства и гинекологии им. Д.О. Отта РАМН, Международный центр репродуктивной медицины, Санкт-Петербург Литература 1. Аншина М.Б. Принципы гормонального мониторинга в программе ЭКО. Пробл репрод 1995;2:43. 2. Корсак В.С., Исакова Э.В., Воробьева О.А., Каменецкий Б.А., Кирсанов А.А. Применение золадекса (гозерелина) в схеме индукции суперовуляции в программе ЭКО. Пробл репрод 1996;3:23—27. 3. Леонов Б.В., Кулаков В.И., Фанченко Н.Д., Щедрина Н.Д., Яворская К.А., Смольникова В.Ю. Декапептил-депо и декаптил-дейли в реализации программы экстракорпорального оплодотворения. Пробл репрод 1996;1:54—58. 4. Никитин А.И. Факторы неудач в программах вспомогательной репродукции. Пробл репрод 1995;2:36—42. 5. Al-Shawaf T., Yang D., Al-Magid Y. et al. Ultrasonic monitoring during replacement of frozen/thawed embryos in natural and hormone replacement cycles. Hum Reprod 1993;8:2068—2074. 6. ART World Report 1995. Abstracts from 10th World Congress on IVF and Assisted Reprodaction. J Assist Reprod Genet 1997;14:5:(Suppl):256—265. 7. Broden H., Lundin K., Bergh C. Fertilization, cleavage and pragnancy rates of oocytes from large and small follicules. Hum Reprod June 1997; 12(Abstr):1:14. 8. Check J.H., Nowroozi K., Choe L., Lurie D., Dietterich C. The effect of endometrial thickness and echo pattern on in vitro fertilization outcome in a donor oocyte embryo transfer cycle. Fertil Steril 1993;59:72—75. 9. Chenetty Ph., Sauer M., Paulson R. Very high serum E2 levels are not detrimental to clinical outcome of IVF. Fertil Steril 1990;54:5:858—862. 10. Chetkowski R.J., Rode R.A., Burruel V., Nass T.E. The effect of pituitary suppression and the women’ s age on embryo viability and uterine receptivity. Fertil Steril 1991;56:1095—1103. 11. Coulam C.B., Bustillo M., Soenksen D.M., Britten S. Ultrasonographic predictors of implantation after assisted reproduction. Fertil Steril 1994;62:1004—1010. 12. Crosignani P., Carena Maini M. et al. Human prolactin releas by FSH, LH, HCG. Hum Reprod 1991;6:8:1070—1073. 13. Dickey R.P., Olar T.T., Curole D.N., Taylor S.N., Rye P.H. Endometrial pattern and thickness associated with pregnancy outcome after assisted reproduction technologies. Hum Reprod 1992;7:418—421. 14. Eichler C., Krampl E., Reichel V. et al. The relevance of endometrial thickness and echo patterns for the success of in vitro fertilization evaluated in 148 patients. J Assist Reprod Genet 1993;10:223—227. 15. Filicori M., Cognigni G.E., Arnone R. et al. Role of different GnRH agonists regimens in pituitary suppression and the outcome of controlled ovarian hyperstimulation. GnRH analogues and Reproductive Medicine. Edited by Edwards R.G., Beard H., Vermeiden J.P.W. 1996;126. 16. Filicori M., Flamigni C., Cognigni G.E. Different gonadotropin and leuprorelin ovulation induction regimens markedly affect follicular fluid hormone levels and folliculogenesis. Fertil Steril 1996;65:387—393. 17. Forman R., Robinson J., Egan D. et al. Follicular monitoring and outcome of in vitro fertilization in gonadotropin- releasing hormone- agonist- treated cycles. Fertil Steril 1991;55:3: 657—573. 18. Hassiakos D., Toner J., Muasher S. Implantation and pregnancy rates in relation to oestradiol and progesteroni profiles in cycles with and without the use of gonadotropinreleasing hormone agonist suppression. Hum Reprod 1990;5:8: 1004—1008. 19. Howles C., McNamee M., Edwards R. Effect of tonic level of LH on outcome of IVF. Lancet 1994;6:521—522. 20. Inaudi P., Germond M., Senn A., De Grandi P. Timing of hCG administration in cycles stimulated for In Vitro Fertilization: specific impact of heterogeneous follicle sizes and steroids concentration in plasma and follicle fluid on decision procedures. Gynecol Endocr 1995;9(3):201—208. 21. Kagawa T., Yamano Sh., Nishida S. et al. Relationship among serum level of LH, E2, progesterone during follicle stimulation and results of IVF and ET. J Assist Reprod Genet 1992;9:2:106—112. 22. Manassiev N.A., Davies W.F.R., Leonard T., Pavlovich B. Does endometrial thickness at the time of embryo transfer in an IVF cycle relate to pregnancy rates? Hum Reprod June 1997;12 (Abstr 1):138. 23. Miller K.F., Goldberg J.M., Falcone T. Follicle size and implantation of embrios from in vitro fertilization. Obst Gynecol 1996; 88(4 Pt 1): 583—586. 24. Salat-Baroux J., Alvarez S., Antoine J. et al. Comparision between long and short protocols of LHRH agonist in the treatment of polycystic ovary disease by IVF. Hum Reprod 1988;3:4:535—539. 25. Spitzer D., Murach K., Lottspeich E. Different protein patterns derived from follicular fluid of mature and immature human follicles. Hum Reprod 1996;11:4:798—807. 26. Tan S., Kingsland C., Cambell S. et al. The long protocol of administration of gonadotropin-releasing hormone aganist is superior to the short protocol for ovarian stimulanion for in vitro fertilization. Fertil Steril 1992;57:4:810—814. 27. World Health Organization. A prospective multicentre trial of the ovulation method of natural family planning. III. Characteristics of the menstrual cycle and of the fertile phase. 28. Younis J.S., Simon A., Laufer N. Endometrial preparation: lessons from oocyte donation. Fertil Steril 1996;66:6:873—883. 29. Zegers-Hochschild F., Fernandez E., Mackenna A., Fabres C. The empty follicle syndrome: a pharmaceutical industry syndrome. Hum Reprod 1995;10:9:2262—5. |