Y-хромосома и мужское бесплодие.
|
В последнее десятилетие усилился интерес к Y-хромосоме человека. В первую очередь это связано с тем, что установлена связь между мужским бесплодием и делециями, возникающими на Y-хромосоме, что указывает на присутствие генов, необходимых для развития мужских зародышевых клеток. Общеизвестно, что бесплодием страдают примерно 15% супружеских пар, и в 40–50% этих случаев мужчина имеет количественные и/или качественные нарушения сперматогенеза [1]. Сперматогенез – сложный биологический процесс, который зависит от точно контролируемого каскада включения и выключения определенных генов, которые запускают процесс пролиферации сперматогоний, инициации и завершения мейоза и морфологическую дифференцировку сперматид в зрелые сперматозоиды. Мутации в любом из этих генов могут оказывать огромное влияние на сперматогенез в целом.
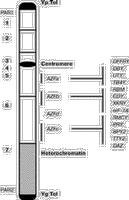
Y-хромосома составляет 2–3% гаплоидного генома человека. Это акроцентрическая хромосома, которая содержит соответственно короткое (Yp) и длинное (Yq) плечи, разделенные центромерным участком, необходимым для хромосомной сегрегации. С помощью цитологических исследований определены три участка Y-хромосомы: 1) псевдоаутосомные участки (PAR) расположены на конце как короткого (PAR1), так и длинного плеча (РАR2)хромосомы; 2) эухроматиновый участок расположен дистально от PAR1, состоит из парацентрического участка короткого плеча, центромеры и парацентрического участка длинного плеча хромосомы; 3) гетерохроматиновый участок включает дистальный Yq. Он полиморфный по длине у разных мужчин (у некоторых представителей он составляет почти половину хромосомы). Псевдоаутосомным является тот участок Y-хромосомы, где в процессе мейоза происходит конъюгация и обмен генетическим материалом с псевдоаутосомным участком X-хромосомы. Соответственно гены, расположенные на псевдоаутосомных участках X- и Y-хромосом, наследуются как аутосомные гены. Бульшая часть (95%) длины Y-хромосомы не принимает участие в рекомбинации и поэтому называется нерекомбинирующей (NRY). Этот участок представляет гаплоидную часть генома человека и включает гетерохроматиновые и эухроматиновые участки хромосомы. Гетерохроматиновый участок, вероятно, генетически инертен и в основном состоит из двух семейств высокоповторяющихся последовательностей (DYZ1 и DYZ2), содержащих приблизительно 5000 и 2000 копий каждого повтора соответственно. Эухроматиновый участок также имеет многочисленные повторяющиеся последовательности, но наряду с ними он содержит гены, определяющие пол (SRY), онкоген, провоцирующий опухоли в дисгенетических гонадах (GBY), ген, определяющий рост (GCY), группу генов, контролирующих гаметогенез у мужчин (AZF-локус), и др. [2].
Гены и генные семейства AZF региона AZFa-участок располагается в области интервала N5 в проксимальной части Yq и его размер оценивается приблизительно в 1–3 Мб (см. рисунок). В настоящее время в этом участке обнаружено несколько генов или с помощью прямого клонирования генов человека или с помощью клонирования мышиных генов с последующей идентификацией гомологичных генов у человека. Известно, что они входят в группу X-Y гомологичных генов, принимающих участие в гаметогенезе [7]: 1) гены DFFRY/DFFRX – гомологи гена Drosophila Developmental gene Fats Facets (DFFRY), кодируют белки, которые могут быть вовлечены в процесс дэубикитизации. Основываясь на данных о фенотипе, связанном с мутациями в гомологе этого гена у дрозофилы, предполагается, чтo ген DFFRY участвует в гаметогенезе [8]; 2) гены DBY/DBX принадлежат к семейству Dead-box белков, кодируют АТФ-зависимые-РНК-хеликазы, которые функционируют как ключевые элементы в метаболизме РНК клетки [9]; 3) гены UTY/UTX. Ген UTY кодирует специфичный для мужчин антиген H-YD [10]; 4) ТВ4Y/TВ4Х. Ген TВ4Y кодирует изоформу тимозина В4, которая может быть вовлечена в процесс секвестрации актина [11]. Гены DBY, UTY и ТВ4Y, по-видимому, вовлечены в клеточный «housekeeping» (неспецифические физиологические клеточные функции) и имеют несколько общих характеристик: 1) повсеместная тканевая экспрессия; 2) наличие единичных копий на Y-хромосоме; 3) каждый ген имеет гомолог на Х-хромосоме (гомология составляет больше 85%), который не подвергается репрессии при инактивации Х-хромосомы. AZFb-участок располагается между интервалом 5 и проксимальной частью интервала 6 (см. рисунок). Его размер составляет 1–3 Мб. В настоящее время есть данные по пяти генам внутри этого интервала: 1. Ген RBM (RNA-Binding Motif (RBM) в сокращенной форме YRBM) кодирует ядерные белки, специфичные для зародышевых клеток. Более 30 копий гена RBM находятся на обоих плечах Y-хромосомы [12–14]. АZFb-участок содержит по крайней мере одну функциональную копию гена RBM, расположенную в дистальной части этого делеционного интервала. Показано, что существует зависимость между наличием делеций в дистальной части AZFb (участки sY142-sY145) и отсутствием белков, которые узнаются антителами, направленными против RBM в тестикулярных отделах [15]. По-видимому, семейство генов RBM специфично экспрессируется в ядрах сперматогоний и ранних сперматоцитов [16]. Высказано предположение, что семейство генов RBM произошло от предкового аутосомного гена. Ген RBM имеет 67% гомологии с геном HNRNPG, который локализован на хромосоме 6 и экспрессируется во многих тканях [17]. Дупликация и транспозиция гена HNRNPG на Y-хромосому должны были произойти более чем 130 млн лет назад до дивергенции сумчатых от остальных млекопитающих [18]. 2. Ген CDY специфично экспрессируется в тестикулах мужчин. CDY кодирует новый белок с хромодоменом, который может взаимодействовать с гетерохроматином и, таким образом, модифицировать ДНК или хромосомные белки [19]. 3. Ген XKRY кодирует полипептид, аналогичный белку ХК, и является мембранным транспортным белком [20]. 4. Ген eIF-1A кодирует эукариотический фактор инициации трансляции 1А [21] и картирован на 5Q между sY127 и sY129 [22]. Гомология последовательностей этого гена на Х- и Y-хромосомах составляет 97%, и Х-гомолог избегает инактивации. Эти гомологи экспрессируются как на X-, так и на Y-хромосоме с высоким уровнем экспрессии в тестикулах. 5. Ген SMCY кодирует последовательность, гомологичную мышиной кДНК на Y-хромосоме [23]. Биологическая функция SMCY не известна, но он кодирует специфический для мужчин мембранный клеточный белок – H-Y антиген. AZFc-участок располагается проксимально по отношению к гетерохроматину. Его размер составляет приблизительно 1,4 Мб (см. рисунок), и он содержит: 1) кластер генов под общим названием DAZ (Deleted in Azoospermia) [24, 25]; 2) две копии гена PRY, кодирующий новый белок, сходный с PTP-BL (предшественник белка тирозиновой фосфатазы) [26]; 3) ген BPY2, кодирует новый основной белок [7]; 4) ген ТТY2, кодирует тестикулярный транскрипт (Testis Transcript Y2 (TTY2) [7]; 5) копии генов CDY и RBM [7]. Все эти гены специфично экспрессируются в тестикулах и имеют множественные копии на Y-хромосоме. Гены DAZ содержат 10 экзонов. Показано, что DAZ-транскрипты сильно полиморфны по структуре и числу транскрипционных единиц 7-го экзона [25]. J.A. de Vries и соавт. [27] изучали структуру и организацию DAZ-участка с помощью FISH-анализа. Обнаружены два небольших DAZ-кластера в интерфазных ядрах соматических клеток и сперматозоидов. Подтверждена локализация кластеров в 6-м интервале длинного плеча Y-хромосомы. Определено расстояние между кластерами, оно составило примерно 400 тыс. пар нуклеотидов. FISH на растянутых нитях хроматина показал наличие 2 генов на кластер. По-видимому, DAZ-гены расположены в кластерах в инвертированном положении – «голова к голове». При использовании зондов на 1 и 2–7 экзоны выявлены 3 функциональные копии гена. Гены DAZ транскрибируются в половых клетках мужчин. Известно, что его гомолог у Drosophila принимает участие в сперматогенезе [28]. DAZ имеет 89% гомологии с аутосомным геном DAZL1 (DAZ like-autosomal 1), который располагается на хромосоме 3 человека [25]. Предполагается, что ген DAZ, расположенный на Y-хромосоме, произошел путем транслокации и амплификации предкового аутосомного гена [25]. DAZL1 экспрессируется специфично в тестикулах, и мутации этого гена могут быть причиной аутосомного рецессивного мужского бесплодия. У мышей нет гена DAZ, расположенного на Y-хромосоме, но они имеют единичный аутосомный ген DAZl1 [29]. Целенаправленные мутации в DAZl1 у мышей приводят к полному отсутствию как сперматогенеза, так и фолликулогенеза, демонстрируя тем самым, что этот ген необходим для нормального функционирования гаметогенеза [30]. B.Habermann и соавт. [31] изучали локализацию белков, которые кодируются генами DAZ, в тестикулярной ткани и зрелых сперматозоидах у мужчин. Установлено присутствие DAZ белков во внутренней выстилке зародышевого эпителия, в поздних сперматидах и в хвосте сперматозоидов. Это подтверждает функцию DAZ белков в метаболизме РНК поздних сперматид – хранение и транспорт специфичной для тестикулов мРНК, трансляция которой репрессируется до образования зрелых сперматозоидов. Происхождение и механизм образования Y-делеций Не считая немногих описанных случаев наследования Y-делеций, большинство делеций встречается как de novo событие. Остается не вполне ясным, в клетках какого типа возникают эти делеции. Наиболее вероятно тестикулярное происхождение, хотя делеции могут возникать и в оплодотворенных яйцеклетках и в эмбрионах разных стадий развития, препятствуя образованию сперматогоний у плода и, соответственно, снижая сперматогенез у мужчин [32]. Относительно высокая частота Y делеций предполагает, что Y-хромосома подвержена спонтанным потерям генетического материала. Природа этого явления остается предметом дискуссий. Одна из возможностей – необычные рекомбинационные события между участками повторов с гомологичными или сходными последовательностями между X- и Y-хромосомами (например, Alu повторы или семейства генов) [33] или внутри самой Y-хромосомы из-за несбалансированного обмена между сестринскими хроматидами [34]. Нестабильность Y-хромосомы может быть также вызвана наличием кластеризованных, часто повторяющихся элементов, расположенных вдоль ее длины. Однако остается вопрос, почему одни мужчины имеют АZF-делеции, а другие – нет? Это может быть отчасти связано с индивидуальной организацией последовательностей на Y-хромосоме, которая способствует образованию делеций в AZF-локyce. Соответственно одни индивидуумы будут более склонны к образованию делеций, чем другие. Клинические аспекты Yq делеций Естественно, что когда была выявлена зависимость между наличием микроделеций на Y-хромосоме и различными нарушениями сперматогенеза, сразу же стал ряд вопросов, на которые необходимо было ответить, прежде чем использовать Y-микроделеции как молекулярно-генетические маркеры при тестировании бесплодия у мужчин. Кроме того, необходимость таких исследований была вызвана широким внедрением в практику лечения бесплодия новых вспомогательных репродуктивных технологий, таких, как ИКСИ, позволяющих иметь детей супружеским парам, в которых отцы страдают тяжелыми формами гипосперматогенеза или даже синдромом клеток Сертоли типа II. Если существует связь между микроделециями Y-хромосомы с перечисленными заболеваниями, то велика вероятность передачи сыновьям этих генетических дефектов. Также новые знания о генах, контролирующих сперматогенез, могут привести к более рациональному лечению некоторых видов мужского бесплодия. С 1994 г. несколькими лабораториями были проведены молекулярно-клинические исследования, целью которых было: 1) выявить наиболее часто встречающиеся делегированные участки Yq; 2) определить частоту встречаемости микроделеций у мужчин, страдающих азоо- и олигозооспермией; 3) определить зависимость размера и положения делеций со степенью нарушения сперматогенеза. Частота встречаемости микроделеций Частота встречаемости микроделеций у мужчин, страдающих бесплодием, варьирует в различных исследованиях от 1% [35] до 55% [36] и 58,3% [53]. Существует несколько причин для такого большого диапазона частот. Во-первых, это может быть связано с неоднородностью изучаемых групп. Как правило, они весьма разнообразны и включали в одних случаях только пациентов, страдающих азооспермией, в других – пациентов как с азоо-, так и с олигозооспермией. Олигозоо- и азооспермия являются симптомами и представляют гетерогенную группу различной этиологии. Также нет согласованности и в вопросе, что понимать под идиопатическим бесплодием. В отдельных исследованиях пациенты с аномальными андрологическими диагнозами, такими, как варикоцеле или крипторхизм, рассматриваются как идиопатические, тогда как в других – неидиопатические. Во-вторых, не всегда при постановке диагноза параллельно проводилось кариотипирование и гистологический анализ образцов тканей яичка пациентов. В-третьих, существуют значительные различия в числе проверенных пациентов: в большинстве исследований с небольшим числом пациентов говорится о высокой частоте встречаемости делеций и наоборот. В-четвертых, существуют разногласия в числе используемых STSs, плотности их распределения и положения на карте. M.Kent-First и соавт. [53] обследовали четыре группы мужчин. Первая группа состояла из 78 пациентов, имеющих один из следующих диагнозов: азооспермия, тяжелая форма олигозооспермии, связанная с гипогонадизмом (объем яичек менее 20 мл), блок сперматогенеза и тератозооспермия. Во вторую группу входили 200 пациентов с общим диагнозом бесплодия. Третья группа состояла из 36 бесплодных мужчин с аномальным фенотипом (тяжелые формы гипогонадизма, макроорхидизм, гипоспадия, гинекомастия), у которых было проведено кариотипирование. У некоторых из них были выявлены различные хромосомные аномалии. Четвертая группа служила контролем и состояла из 920 фертильных пациентов. Частота встречаемости микроделеций в этих группах составила соответственно 20,5, 7, 58,3 и 0,87%. Бесплодие и Y-микроделеции В исследование были включены 1176 фертильных мужчин в качестве положительного контроля при скринировании Y-микроделеций. Микроделеции были обнаружены у 4 фертильных мужчин, все они были локализованы в дистальной части АZFb-участка [37]. В данном случае может быть два объяснения: или это редкие полиморфные варианты, или эти мужчины имели олигозооспермию. В большинстве исследований фертильность мужчин определяется на основании того, что они являются отцами хотя бы одного ребенка, тогда как оценка качества их сперматозоидов не проводится. В другом исследовании были обследованы 90 родственников (отцы и братья) со стороны пациентов, имеющих микроделеции. В 5 случаях отцы передали AZFc-делеции своим сыновьям. У одного из отцов размер делеции был больше, чем у инфертильного сына [38], тогда как в остальных четырех случаях размеры делеций у отцов и сыновей были относительно одинаковыми. Предполагается, что гипофертильность у мужчин может компенсироваться нормальной женской фертильностью, и что у некоторых пациентов с делециями продукция сперматозоидов может значительно варьировать во времени (в основном это резкое снижение уровня сперматогенеза). R.Brandell и соавт. [39] исследовали влияние отдельных микроделеций на эффективность лечения и изменение параметров получаемых сперматозоидов у мужчин, страдающих азооспермией. Авторы делают вывод, что микроделеции Y-хромосомы могут значительно влиять на результаты лечения. Так, микроделеции были обнаружены у 22 (8%) из 286 обследованных мужчин. При этом для 6 мужчин с гипогонадизмом, у которых были выявлены Y-микроделеции, назначение кломифенцитрата и тестолактана вызвало значительное повышение уровня тестерона, но при этом уровень сперматогенеза оставался низким. У 8 пациентов с микроделециями было проведено оперативное лечение варикоцеле. После операции не наблюдали улучшения количественных и качественных показателей сперматозоидов. Девяти пациентам с микроделециями в AZFb-участке проводили TESE. У 7 из 9 пациентов в биоптате яичка не было получено тестикулярных сперматозоидов, несмотря на неоднократное проведение TESE. У пациентов, которые имели микроделеции в AZFc-участке, экстракция сперматозоидов прошла успешно, и после проведения ИКСИ у их жен наступила беременность. Вспомогательные репродуктивные технологии и делеции Y-хромосомы Исследование Y-хромосомы рекомендуется всем пациентам, вовлеченным в программу лечения бесплодия методом ИКСИ и страдающим необструктивной формой азооспермии, а также тем, у которых концентрация сперматозоидов в эякуляте составляет менее 5 млн/мл. Подтверждение диагноза на наличие микроделеции объясняет причину нарушения сперматогенеза и информативно для клиницистов, так как позволяет избежать ненужного медицинского (гормонального или негормонального) и хирургического (оперативное лечение варикоцеле) лечения. На сегодняшний день для пациентов с тяжелыми формами олигозооспермии эффективной терапией является только ИКСИ, а для пациентов с азооспермией – ИКСИ в сочетании с извлечением тестикулярных сперматозоидов. Недавно появилось сообщение, что определенный тип микроделеции на Y-хромосоме у пациентов с азооспермией может иметь прогностическое значение с точки зрения возможности нахождения некоторого количества сперматозоидов и/или зрелых сперматид в ткани яичка, полученной с помощью TESE. Предварительные результаты показывают, что AZFb-делеции в большей степени связаны с неудачными попытками извлечения сперматозоидов, тогда как у 71% пациентов со стандартными AZFc-микроделециями могут быть обнаружены зрелые сперматозоиды [39, 40]. Однако большие AZFc-микроделеции также ведут к отсутствию сперматозоидов. Хотя эти положения основываются на недостаточном количестве клинических случаев, они были получены несколькими различными лабораториями [52]. S.Silber и coaвт. [41] также изучали, как различные типы и размеры делеций Y-хромосомы определяют степень сперматогенных дефектов и как они влияют на результаты TESA-ИКСИ. Из 19 инфертильных мужчин с Y-микроделециями 14 имели делеции, ограниченные DAZ-участком. Для них был выявлен незначительный уровень сперматогенеза в тестикулах или обнаружены сперматозоиды в эякуляте. Пять пациентов имели делеции, расположенные проксимально DAZ-региону, и ни у одного из них не выявлено сперматогенеза вообще. Таким образом, для пациентов с азооспермией, у которых микроделеции ограничиваются только DAZ-участком, характерно присутствие небольшого количества тестикулярных или эякулированных сперматозоидов, которых в большинстве случаев достаточно для проведения ИКСИ. Делеции большего размера приводят к полному отсутствию эякулированных и тестикулярных сперматозоидов. Анализ подтверждает наличие нескольких, отличных от DAZ, генов на нерекомбинирующей части Y-хромосомы, которые вовлечены в процесс сперматогенеза. Это согласуется с точкой зрения, что Y-хромосома «собиралась» в процессе эволюции высших приматов из аутосомных генов, ответственных за сперматогенез, с помощью транспозиции, амплификации и последующей девергенции. Имеется несколько сообщений [42], что даже у некоторых пациентов, страдающих синдромом клеток Сертоли (СКС), можно найти единичные тестикулярные сперматозоиды. Правда, для этого необходимо проводить множественную тестикулярную биопсию, которая вредна для пациентов. G.Song и соавт. попытались проверить применимость молекулярных маркеров для определения возможности извлечения тестикулярных сперматозоидов, пригодных для ИКСИ. Чтобы проверить экспрессию специфических генов зародышевых клеток в тестикулярной ткани, использовали полимеразную цепную реакцию, сопряженную с обратной транскрипцией (RT-PCR). У 28 пациентов с азооспермией и олигозооспермией проводили тестикулярную биопсию. Использовали 3 пары праймеров: для гена DAZ, который экспрессируется в зародышевых клетках, для гена PGK2 (экспрессируется в поздних сперматоцитах и сперматидах) и для гена протамина 2 (Р2) (экспрессируется в сперматидах). Для пациентов с нормальным сперматогенезом были определены транскрипты для всех трех генов. Однако профили экспрессии этих генов для пациентов, страдающих СКС, были различными. Р2 транскрипты определили только у 2 (17%) из 12 таких пациентов. Для этих 2 пациентов были найдены зрелые сперматозоиды, проведено ИКСИ и получено нормальное оплодотворение. У 3 из 12 пациентов с СКС была установлена полная аплазия зародышевых клеток, при этом транскрипты всех 3 генов отсутствовали. Показано, что у пациентов с повышенным уровнем экспрессии генов DAZ и РGК2 наблюдается тенденция к нормальному сперматогенезу. S.Silber и coaвт. [43] определили у 13% пациентов с азооспермией и 7% пациентов с тяжелой формой олигозооспермии наличие делеций Y-хромосомы, которые отсутствовали у их отцов или братьев. Большинство делеций встречалось в DAZ-регионе. Цель данного исследования состояла в том, чтобы проверить, как наследуются Y-микроделеции детьми, родившимися после проведения ИКСИ. В данную программу было включено 9 супружеских пар, после проведения лечения методом ИКСИ-ПЭ у 6 из 9 – наступила беременность. Из 6 беременностей одна закончилась выкидышем, две – рождением двойни. Трое из 7 детей были девочками, двое – мальчиками, и у одной пары беременность продолжалась (с помощью УЗИ определена двойня). Три девочки имели нормальный ХХ кариотип, были здоровы и не имели врожденных аномалий. Двое мальчиков имели точно такие же делеции Y-хромосомы, как и их отцы, но тем не менее имели нормальный ХY-кариотип. Один из мальчиков был здоров (если не считать присутствие микроделеции). Другой мальчик имел тяжелую форму атрезии легочной артерии и трехстворчатого клапана и умер в течение 1-й недели после хирургической операции. Оба мальчика имели нормальные гениталии. На основании полученных данных были сделаны выводы: 1) de novo делеции Y-хромосомы у пациентов с азооспермией и с тяжелыми формами олигозооспермии не являются препятствием к рождению нормальных детей с использованием ИКСИ; 2) впервые четко продемонстрировано, что микроделеции Y-хромосомы передаются сыновьям от отцов. Делается предположение, что эти сыновья будут иметь те же проблемы с бесплодием, как и их отцы; 3) заболевание сердца у одного из 7 детей, вероятно, не связано с выявленной делецией, но данный случай еще раз указывает на необходимость внимательного обследования и наблюдения за детьми, родившимися после проведения ИКСИ. В нескольких публикациях [44, 45] также показано, что частота оплодотворения при использовании сперматозоидов, полученных от пациентов с Y-микроделециями, и развитие эмбрионов были сравнимы с соответствующими показателями при использовании сперматозоидов без делеций. Так, частота оплодотворения, дробления и наступления беременности после проведения ТЕSЕ-ИКСИ у больных, страдающих азооспермией и имеющих Y-делеции, составила соответственно 47, 58 и 29%, а у пациентов с таким же диагнозом, но интактной Y-хромосомой – соответственно 42, 62 и 29%. При олигозооспермии эти показатели составили 64, 56 и 46% при интактной Y-хромосоме и 68, 65 и 50% при наличии Y-микроделеций [52]. Авторы этих работ считают, что хотя отец передаст своему сыну этот генетический дефект, фенотип сына может значительно варьировать, и степень субфертильности или инфертильности не может быть точно предсказана. При этом подчеркивается необходимость скринирования мальчиков, родившихся с помощью ИКСИ, и проведения тщательного и долгосрочного наблюдения за этими детьми для оценки полной безопасности используемых методов ВРТ. Так как определенные микроделеции связаны с прогрессивными изменениями от олигозооспермии до азооспермии [46, 47], для сыновей с микроделециями может быть предложена превентивная терапия (криоконсервация сперматозоидов в раннем возрасте с последующим их использованием в программах ВРТ). Корреляция между генотипом и фенотипом Р.Vogt и соавт. [6] установили, что микроделеции Y-хромосомы образуют в основном определенные делеционные паттерны в трех неперекрывающихся участках на проксимальной, средней и дистальной частях Yq11, обозначенные как AZFa, b и с соответственно. Предполагается, что в каждом участке микроделеция коррелирует с определенным гистопатологическим профилем. Так, микроделеции, встречающиеся в AZFa-участке, часто связаны с СКС типа I (полное отсутствие спермагенного эпителия) или тяжелыми формами олигозооспермии. Микроделеции в AZFb приводят к блоку сперматогенеза обычно на стадии сперматоцитов, а делеции в AZFc связаны с СКС типа II (присутствуют сперматогонии с ограниченным сперматогенезом) или гипосперматогенезом. Пациенты, у которых микроделеции ограничиваются АZFd-участком, могут иметь широкий диапазон нарушений сперматогенеза вплоть до олигозооспермии II степени и/или тяжелых форм тератозооспермии (более 90% сперматозоидов с аномальной морфологией) [53]. Однако до сих пор не ясно, существует ли четкая корреляция между определенными делециями и фенотипом. Например, S.Quereshi и соавт. [48] сообщили о делеции в AZFb-участке, связанном с тяжелой формой олигозооспермии, a J.PRYor и соавт. [37] обнаружили делецию в AZFb-участке у инфертильного мужчины, которая также была связана с тяжелой формой олигозооспермии. Отсутствие четкой генотип/фенотип корреляции может быть связано с рядом факторов. Наиболее важные факторы – отсутствие общего протокола для выполнения тестикулярной биопсии (число взятых образцов) и определение категории гистопатологии. Множественные тестикулярные биопсии могут выявить наличие «островков» ткани, где присутствует «нормальный» сперматогенез, и тем самым появляется возможность изменить диагноз СКС типа I на СКС типа II. Также важно помнить, что состояние гистологического образца может меняться в зависимости от вида патологического повреждения, т.е. прогрессивная редукция половых клеток может привести в конечном счете к появлению СКС типа I. Доказательством этого феномена служат некоторые клинические исследования. Taк, S.Girardi и соавт. [47] наблюдали пациента с AZF-делецией в течение 30 мес и обнаружили прогрессивное снижение концентрации сперматозоидов от тяжелой формы олигозооспермии до азооспермии. Однако, несмотря на противоречивые данные, наблюдаются некоторые общие генотип/фенотип тенденции: 1) микроделеции Y-хромосомы обнаружены у мужчин с азооспермией или тяжелыми формами олигозооспермии; 2) более высокая частота Yq-делеций выявлена у пациентов с азооспермией и аномальным фенотипом (гипогонадизм и др.) по сравнению с пациентами с тяжелой формой олигозооспермии; 3) более протяженные делеции в основном связаны с более тяжелыми нарушениями сперматогенеза; 4) АZFa-делеции встречаются наиболее редко (1–5%) и в основном связаны с СКС типа I; 5) AZFc и AZFc + b наиболее часто встречающиеся делеции, они могут быть связаны с различными сперматогенными дефектами. C.Foresta и coaвт. [49] изучали распределение Yq11-микроделеций с помощью ПЦР-анализа у большой группы пациентов с точно установленной необструктивной формой азооспермии. Цель исследования состояла в том, чтобы установить, существует ли связь между специфическими паттернами Yq11-микроделеций и идиопатическим СКС. Были отобраны 18 пациентов с СКС и протестированы с помощью ПЦР, используя 29 STS. Yq-микроделеции были обнаружены у 10 (55,5%) пациентов. Отцы или братья 6 из 10 пациентов с делециями имели интактные Y-хромосомы. Поэтому делеции у этих 6 пациентов рассматривались как de novo делеции, и было высказано предположение, что они являются причиной возникновения СКС. Yq-микроделеции, выявленные у пациентов, можно было разделить на два четко обозначенных участка. Первый участок был расположен проксимально к Yq в 5-м интервале (см. рисунок) и был делетирован у всех пациентов. Второй участок, включающий гены DAZ и расположенный в 6-м интервале, был делетирован у 8 из 10 пациентов. Ген RBM был делетирован только у 2 пациентов, у которых наблюдали самые большие делеции. Это подтверждает данные о том, что гены RBM, по-видимому, специфично не связаны со СКС [6, 24, 36, 37]. Распространенность DAZ-делеций у пациентов с СКС очень высока, что подтверждает гипотезу о роли этих генов в сперматогенезе. Тем не менее, по мнению авторов, DAZ-делеции не обязательно ведут к установлению фенотипа СКС, так как последовательности генов DAZ присутствовали у 2 из 10 пациентов с СКС, имеющих Yq-микроделеции. Более того, делециям в генах DAZ всегда сопутствовали делеции в 5-м интервале. Авторы считают, что делеции в 5-м интервале Yq имеют прямую зависимость с СКС, так как этот участок был делетирован у всех пациентов. С другой стороны, сочетание делеции в генах DAZ и делеций в 5-м интервале присутствовало у 80% пациентов с СКС. В работе отмечается, что ПЦР-анализ часто показывает присутствие единичных разбросанных микроделеций на Yq. По этому поводу существует несколько предположений, ни одно из которых еще не доказано [50]. Во-первых, ПЦР-анализ может не обнаружить отдельные микроделеции; во-вторых, порядок расположения STS на Yq еще может быть установлен неточно, так как существуют расхождения в опубликованных делеционных картах; в-третьих, определенные STS могут входить в состав повторяющихся последовательностей и ПЦР-продукты соответственно будут результатом амплификации различных сайтов; в-четвертых, разногласия могут быть следствием сложных перестановок нуклеотидных последовательностей ДНК на Yq в результате рекомбинационных событий. Делеция в интервале 5D-5P, которая была обнаружена у одного пациента в этом исследовании, входила в состав любой другой делеции 5-го интервала. По мнению авторов, только эта делеция всегда связана с тестикулярным фенотипом билатерального идиопатического СКС, и именно она представляет «сперматогенный локус», который включает один или несколько генов, необходимых для развития сперматогенного эпителия. Все пациенты с Yq-микроделециями не имели других патологий кроме СКС. В отличие от классификации P.Vogt и соавт. [6], которые связывали делеции в AZFa-участке с СКС, а в AZFb-участке – с блоком на стадии сперматоцит, С.Foresta и соавт. [50] дали другую классификацию делеций и показали, что самая маленькая, но самая информативная делеция (5D-5P) находится на границе между AZFa- и AZFb-участками. По мнению авторов, отсутствие делеций у оставшихся 45% обследованных пациентов может отражать наличие точковых мутаций в этом участке, которые не выявляются ПЦР-методом, или можно предположить, что СКС фенотип в этих случаях остается идиопатическим и может иметь другую этиологию. Заключение По мнению ряда авторов, на сегодняшний день точно не установлено, включает ли Y-хромосома специфический набор генов, ответственных за сперматогенез, которые работают как основные регуляторы этого процесса, или они (гены) выполняют роль минорных факторов, которые усиливают качество и/или эффективность сперматогенеза. Положение генов внутри трех AZF-участков, профили их экспрессии и данные по гомологии (DFFRY, DAZ) еще весьма предположительны и служат только косвенными доказательствами для вовлечения их в контроль за сперматогенезом. Хотя есть и значительные достижения в области исследования Y-хромосомы и ее роли в мужском бесплодии, остается много невыясненных вопросов. В первую очередь это отсутствие четкой корреляции между генотипом (микроделециями) и фенотипом (диагнозом). Нужно также провести исследования в группах людей различного этнического/географического происхождения для того, чтобы определить, существуют ли популяционные различия между частотой, положением и протяженностью делеций. Обследование мужчин с нормальными показателями сперматозоидов могло бы дать представление о распространении полиморфных вариантов микроделеций в популяции. Как уже отмечалось, в настоящее время нет данных о негативном влиянии AZF-микроделеций на частоту оплодотворения, дробления и наступления беременности после ИКСИ. Однако инфертильный немозаичный мужчина, у которого обнаружены AZF-микроделеции при тестировании ДНК, выделенной из лейкоцитов, передаст эти мутации всем своим будущим сыновьям. В этих случаях можно рекомендовать супружеским парам преимплантационное определение пола и перенос только XX эмбрионов. Передача мутаций у мужчин с гонадным мозаицизмом зависит от соотношения интактной и мутантной Y-хромосом в зародышевой линии клеток. M.Kent-First и соавт.[51] считают, что для избежания передачи AZF-микроделеций сыновьям супружеским парам, в которых у мужчин установлен гонадный мозаицизм по этим мутациям, должна быть предложена преимплантационная генетическая диагностика, которая позволит отделить полученные с помощью ИКСИ эмбрионы с AZF-микроделециями от эмбрионов с интактной Y-хромосомой до выполнения ПЭ. По рекомендации международных организаций, занимающихся проблемами бесплодия, инфертильным пациентам, которым назначено лечение с помощью ИКСИ, следует проводить генетические консультации и наряду с кариотипированием выполнять анализ AZF-участка Y-хромосомы. И.К. Гоголевская, П.А. Гоголевский Институт молекулярной биологии им. В.А. Энгельгардта РАН; Московский центр по лечению бесплодия ЭКО, Москва Литература 1. Mosher W.D. Reproductive impairements in the United States, 1965–1982. Demography 1985; 22: 415–430. 2. Lahn В.Т. and Page D. Functional coherence of the human Y chromosome. Science 1998; 278: 675–680. 3. Tiepolo L. and Zuffardi O. Localization of factors controlling spermatogenesis in the nonfluorescent portion of the human Y chromosome long arm. Hum Genet 1976; 34: 119–124. 4. Vergnaud G. et al. A deletion map of the human Y chromosome based on DNA hybridization. Am J Hum Genet 1986; 38: 109–124. 5. Vollrath D. et al. The human Y chromosome: a 43-interval map based on naturally occuring deletions. Science 1992; 258: 52–59. 6. Vogt P.H. et al. Human Y chromosome azoospermia factors (AZF) mapped to different subregions in Yq11. Hum Mol Genet 1996; 5: 933–943. 7. Lahn В.Т., Page D.C. Functional coherence of the human Y chromosome. Science 1997; 278: 675–680. 8. Brown G.M., Furlong R.A., Sargent C.A. Characterisation of the coding sequence and fine mapping of the human DFFRY gene and comparative DFFRY gene. Hum Mol Gen 1998; 7: 97–107. 9. Schimid S.R., Linder P. D-E-A-D protein family of putative RNA helicases. Molec Microbiol 1992; 6: 283–292. 10. Greenfield A., Scott D. et al. An H-YD epitope is encoded by a novel mouse Y chromosome gene (letter). Nature Genet 1996; 14: 474–478. 11. Gondo H. et al. Differential expression of the human thymosin-beta 4 gene in lymphocytes, macrophages, and granulocytes. Immunol 1987; 139: 3840–3848. 12. Ma К. et al. A Y chromosome gene family with RNA-binding protein homology: candidates for the azoospermia factor AZF controlling spermatogenesis. Cell 1993; 75: 1287–1295. 13. Prosser J. et al. Degeneracy in human multi-copy RBM (YRRM), a candidate spermatogenesis gene. Mammal Genome 1996; 7: 835–842. 14. Chai N.N., Salido E.C., Yen P.H. Multiple functional copies of the RBM gene family a spermatogenesis candidate on the human Y chromosome. Genomics 1997; 45: 355–361. 15. Eliott D.J. et al. Expression of RBM in the nuclei of human germ cells is dependent on a critical region of the Y chromosome long arm. Proc Natl Acad Sci USA 1997; 94: 3848–3853. 16. Chandley A.C. and Cooke H.J. Human male fertility-Y linked genes and spermatogenesis. Hum Mol Genet 1994; 3: 1449–1452. 17. Scoulard M. et al. HnRNPG: sequence and characterization of a glycosYlated RNA-binding protein. Nucl Acid Res 1993; 21: 4210–4217. 18. Delbridge M.L. et al. A human candidate spermatogenesis gene, RBM1, is conserved and amplified on the marsupial Y chromosome. Nature Genet 1997; 15: 131–136. 19. James T.C., Elgin S.C. Identification of a nonhistone chromosomal protein associated with heterochromatin in Drosophila melanogaster and its gene. Mol Cell Biol 1986; 11: 3862–3872. 20. Но M., Chelly J., Carter N., Danek A., Crocker P., Monaco A.P. Isolation of the gene for McLeod sYndrome that encodes a novel membrane transport protein. Cell 1994; 77: 869–870. 21. Hershey J.W.B. Translational control in mammalian cells. Ann Rev Biochem 1991; 60: 717–755. 22. Krausz С., McElreavey К., Weissenbach G., Forti G., Bishop C. Identification and mapping of a novel Y chromosome isoform of eIF-1A. Miniposter book, 10th European Workshop on Molecular and Cellular Endocrinology of the testis. Capri 1998; 28/03-01-04. 23. Agulnic A.I. et al. A novel X gene with a widely transcribed Y-linked homologue escapes X-inactivation in mouse and human. Hum Mol Genet 1994; 3: 879–884. 24. Reijo R. et al. Diverse spermatogenic defects in humans caused by Y chromosoir deletions encompassing a novel RNA-binding protein gene. Nature Genet 1995; 10: 383–393. 25. Saxena R. et al. The DAZ gene cluster on the human Y chromosome arose from an autosomal gene that was transposed, repeatedly amplified and pruned. Nat Gen 1996; 14: 292–299. 26. Hendriks W. et al. Molecular cloning of a mouse epithelial protein-tyrosin phosphatase with similarities to submembranous proteins. J Cell Biochem 1995; 59: 418–30. 27. J.W.A. DeVries. Structure and organization of the DAZ gene family. Abstracts. 16th World Congress on Fertility and Sterility. October, 1998. San Francisco, California. 28. Eberhart C.G., Maines J.Z., Wasserman S.A. Meiotic cell requirement for a fly homologue of human Deleted in Azoospermia. Nature 1996; 381: 783–785. 29. Cook H.J., Lee M., Kerr S., Ruggiu M. A murine homologue of the human DAZ gene is autosomal and expressed only in male and female gonads. Hum Mol Gen 1996; 5: 513–516. 30. Ruggiu M. et al. The mouse DAZ La gene encodes a cytoplasmic protein essential for gametogenesis. Nature 1997; 389: 73–77. 31. Habermann В. et al. DAZ (deleted in azoospermia) genes encode proteins located in human late spermatids and in sperm tails. Hum Reprod 1998; 13: 363–369. 32. Edwards R.G. and Bishop C.E. On the origin and frequency of Y chromosome deletions responsible for severe male infertility. Mol Hum Reprod 1997; 3: 549–554. 33. Yen P.H. et al. Frequent deletions of the human X chromosome distal short arm result from recombination between low copy repetitive elements. Cell 1990; 61: 603–610. 34. McClintock В. Chromosome organization and genic expression. Cold Spring Harbor sYmposia on Quantitative Biology. 1951; XVI: 13–21. 35. Van der Vent K. et al. Combined cytogenetic and Y chromosome microdeletion screening in males undergoing intracytoplasmic sperm injection. Mol Hum Reprod 1997; 3: 699–704. 36. Foresta C., Ferlin A., Garolla A., Moro E., Pistorello M., Barbaux S., Rossato M. High frequency of well-defined Y-chromosome deletions in idiopathic Sertoli cell-only sYndrome. Hum Reprod 1998; 13: 302–307. 37. PRYor J.L. et al. Microdeletions in the Y chromosome of infertile men. New Eng J Med 1997; 336: 534–539. 38. Palka G. and Dallapiccola B. Widening of a Y-chromosome interval-6 deletion transmitted from a father to his infertile son accounts for an oligozoospermia critical region distal to the RBM1 and DAZ genes. Am J Hum Genet 1996; 59: 1393–1395. 39. Brandell R.A. et al. Effect of partial Y chromosome deletions on result of treatment for severe male factor infertility. Poster, 16th World Congress on Fert. and Steril. IFFS’98. San Francisco, USA. 1998. 40. Oates R.D. et al. The spectrum of spermatogenic deficiency in 20 men with Y interstitial microdeletions confined to the AZFc (DAZ) region. Poster, 16th World Congress on Fert. and Steril. IFFS’98. San Francisco, USA. 1998. 41. Silber S.J. et al. ICSI and TESE in oligospermic and azoospermic patients with Y chromosome deletions. Poster, 16th World Congress on Fert. and Steril. IFFS’98. San Francisco, USA. 42. Song G.J. A molecular marker to define the presence of the testicular spermatozoa in non obstructive azoospermia patients. Poster, 16th World Congress on Fert. and Steril. IFFS’98. San Francisco, USA. 43. Silber S.J. Pregnancies and children from ICSI using sperm of Y-deleted azoospermic and severely oligospermic men. Poster, 16th World Congress on Fert. and Steril. IFFS’98. San Francisco, USA. 44. Mulhall J.P. et al. Azoospermic men with deletion of the DAZ gene cluster are capable of completing spermatogenesis: fertilization, normal embryonic development and pregnancy occur when retrieved testicular spermatozoa are used for intracytoplasmic sperm injection. Hum Reprod 1997; 12: 503–508. 45. Rossato M. et al. High fertilization rate in conventional in vitro fertilization utilizing spermatozoa from an oligozoospermic subject presenting microdeletions of the Y chromosome long arm. Mol Hum Reprod 1998; 4: 473–476. 46. Simoni M. et al. Screening for deletions of the Y chromosome involving the DAZ (Deleted in Azoospermia) gene in azoospermia and severe oligozoospermia. Fertil Steril 1997; 67: 542. 47. Girardi S.K. et al. Submicroscopic deletions in the Y chromosome of infertile men. Hum Reprod 1997; 12: 1635–1641. 48. Quereshi S.J. et al. PCR screening for Y chromosome microdeletions: a first step towards the diagnosis of genetically determinined spermatogenic failure in men. Mol Hum Reprod 1996; 2: 775–779. 49. Foresta С. et al. High-frequency of well-defined Y-chromosome deletions in idiopathic Sertolli cell-only sYndrome. Hum Reprod 1998; 13: 2: 302–308. 50. Foresta С. et al. Y-chromosome deletions in idiopathic severe testiculopathies. J Clin Endocrinol Metab 1997; 82: 1075–1080. 51. Kent-First M.G. et al. The incidence and possible relevence of Y-linked microdeletions in babies born after ICSI and their infertile father. Mol Hum Reprod 1996; 12: 943–950. 52. Silber S.J et al. Y chromosome deletions in azoospermic and severy oligozoospermic men undergoing intracytoplasmic sperm injection after testicular sperm extraction. Hum Reprod 1998; 13: 3332–3337. 53. Kent-First M. et al. Defining Regions of the Y-Chromosome Responsible for Male Infertility And Identification of a Forth AZF Region (AZFd) by Y-Chromosome Microdeletion Detection. Mol Reprod Develop 1999; 53: 27–41. |