Криоконсервация сперматозоидов человека.
|
Впервые, основываясь на технике криоконсервирования бычьих сперматозоидов, человеческие сперматозоиды успешно криоконсервированы в 1953 г. [1]. В настоящее время во многих странах созданы банки спермы, и использование криоконсервированных сперматозоидов является повседневной практикой. Человеческие сперматозоиды в общем устойчивее к криоконсервации, чем сперматозоиды у большинства млекопитающих. Тем не менее подвижность и оплодотворяющая способность сперматозоидов после криоконсервации уменьшается, причем в достаточно широких пределах, в среднем на 30–70% [2, 3]. Такая широкая изменчивость выживаемости сперматозоидов свидетельствует о различной криорезистентности (устойчивости к криоконсервации). А криорезистентность в свою очередь, главным образом, определяется функцией плазматических мембран: их пластичностью, состоянием ферментных систем, способностью выдерживать деформационные напряжения, особенно возникающие при фазовых переходах лед–вода. Цель настоящей работы – изучить взаимосвязь криорезистентности и функционального состояния плазматических мембран сперматозоидов.
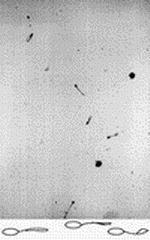
Материал и методы Криоконсервация сперматозоидов проводилась у 50 мужчин с нормозооспермией, обратившихся в клинику по поводу бесплодного брака. Сперму получали мастурбацией после 3–5-дневного полового воздержания. Через час после эякуляции и полного разжижения спермы определяли на анализаторе HAMILTON THORNE концентрацию, процент подвижности, скорость продвижения между двумя измерениями (VAP), скорость прямолинейного движения (VSL), скорость движения сперматозоидов по кривизне индивидуальных треков (VCL), процент быстрых сперматозоидов, скорость которых больше 50 m k /с (RAPID). Процент патологических форм, лейкоциты, клетки сперматогенеза подсчитывался в фазово-контрастном микроскопе при ' 400. Лейкоциты идентифицировали с помощью красителя Лейкоскрин ("Фертипро", Бельгия). При криоконсервации использовали криопротектор Спермфриз ("Фертипро", Бельгия), содержащий глицерин. Замораживание осуществляли в пластиковых соломках объемом 0,2 мл (Крио Вио Систем, Франция) в горизонтальном положении, в 10–12 см над уровнем жидкого азота. Через 15 мин инкубации соломок в парах азота индуцировали в соломках льдообразование прикосновением охлажденным в жидком азоте пинцетом. Через 5 мин после этого соломки опускали в жидкий азот на хранение. Размораживание соломок проводили на водяной бане при 37 ° С. Функциональное состояние плазматических мембран оценивалось посредством изучения способности мембран переносить через себя воду, реагировать на гипотонические и гипертонические условия окружающей среды. Для этого 100 мкл нативной спермы смешивали: а) с 200 мкл дистиллированной воды (водяной тест); б) с 200 мкл раствора хлорида натрия с осмолярностью 150, 280, 510 мосм/кг. Через 5–10 мин после получения суспензии определялись показатели подвижности и морфологические изменения сперматозоидов. Искусственное повреждение плазматических мембран вызывали быстрым замораживанием, погружением суспензии сперматозоидов без криопротектора в жидкий азот. Для определения оптической плотности суспензии сперматозоидов равных концентраций при различных значениях осмолярности раствора хлорида натрия у 10 мужчин полученные суспензии анализировались на спектофотометре ХИТАЧИ -557 (Япония) при длине волны 530 нм в кварцевой кювете размерами 40' 15' 5 мм. Статистический анализ проведен с помощью программы STATISTICA. Результаты По данным подвижности после криоконсервации, условно выделены 2 группы: группа А (27 человек) – сперматозоиды с хорошей криорезистентностью – процент сохранившейся подвижности после криоконсервации больше 50% – 70,0±2,6; группа Б (23 человека) – сперматозоиды с плохой криорезистентностью – процент сохранившейся подвижности меньше 50% – 39,4±2,6. В гипоосмотических условиях (дистиллированная вода, 150 мосм/кг раствора хлорида натрия) хвостовая часть сперматозоидов имеет характерные морфологические изменения (набухание – swelling), отлично выявляемые в фазово-контрастном микроскопе (рис. 1).
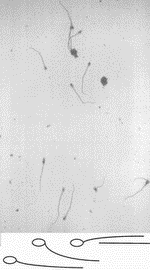
Эти изменения происходят за счет проникновения воды через плазматическую мембрану и свидетельствует о полноценности плазматической мембраны хвостовой части сперматозоида. В нормоосмотических (280 мосм/кг раствора хлорида натрия) и гиперосмотических условиях (510 мосм/кг раствора хлорида натрия) таких выраженных видимых изменений хвостовой части сперматозоида не наблюдается (рис. 2).
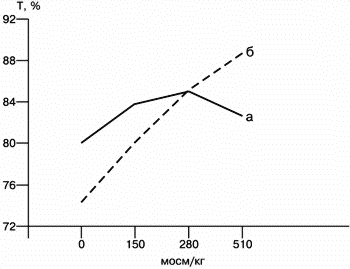
При спектрофотометрии суспензии сперматозоидов в гипоосмотических условиях наблюдается уменьшение коэффицента плотности за счет морфологических изменений хвостовой части сперматозоида, а в гиперосмотических условиях увеличивается плотность суспензиии сперматозоидов за счет реакции головки сперматозоида. Тогда как при спектрофотометрии суспензии сперматозоидов с поврежденными мембранами с увеличением осмолярности раствора происходит уменьшение плотности суспензии сперматозоидов (рис. 3).
a – сперматозоиды с неповрежденными мембранами, б – сперматозоиды с поврежденными мембранами. В гипоосмотических условиях RAPID в группе А больше, чем в группе Б (рменьше 0,04). В гиперосмотических условиях в группе А в сравнении с группой Б выше процент подвижности (рменьше0,0001), VAP (рменьше0,01), VSL (рменьше0,03), VCL (рменьше0,01); RAPID (рменьше0,0005) (см. таблицу). Впервые, основываясь на технике криоконсервирования бычьих сперматозоидов, человеческие сперматозоиды успешно криоконсервированы в 1953 г. [1]. В настоящее время во многих странах созданы банки спермы, и использование криоконсервированных сперматозоидов является повседневной практикой. Человеческие сперматозоиды в общем устойчивее к криоконсервации, чем сперматозоиды у большинства млекопитающих. Тем не менее подвижность и оплодотворяющая способность сперматозоидов после криоконсервации уменьшается, причем в достаточно широких пределах, в среднем на 30–70% [2, 3]. Такая широкая изменчивость выживаемости сперматозоидов свидетельствует о различной криорезистентности (устойчивости к криоконсервации). А криорезистентность в свою очередь, главным образом, определяется функцией плазматических мембран: их пластичностью, состоянием ферментных систем, способностью выдерживать деформационные напряжения, особенно возникающие при фазовых переходах лед–вода. Цель настоящей работы – изучить взаимосвязь криорезистентности и функционального состояния плазматических мембран сперматозоидов. Материал и методы Криоконсервация сперматозоидов проводилась у 50 мужчин с нормозооспермией, обратившихся в клинику по поводу бесплодного брака. Сперму получали мастурбацией после 3–5-дневного полового воздержания. Через час после эякуляции и полного разжижения спермы определяли на анализаторе HAMILTON THORNE концентрацию, процент подвижности, скорость продвижения между двумя измерениями (VAP), скорость прямолинейного движения (VSL), скорость движения сперматозоидов по кривизне индивидуальных треков (VCL), процент быстрых сперматозоидов, скорость которых больше 50 m k /с (RAPID). Процент патологических форм, лейкоциты, клетки сперматогенеза подсчитывался в фазово-контрастном микроскопе при ' 400. Лейкоциты идентифицировали с помощью красителя Лейкоскрин ("Фертипро", Бельгия). При криоконсервации использовали криопротектор Спермфриз ("Фертипро", Бельгия), содержащий глицерин. Замораживание осуществляли в пластиковых соломках объемом 0,2 мл (Крио Вио Систем, Франция) в горизонтальном положении, в 10–12 см над уровнем жидкого азота. Через 15 мин инкубации соломок в парах азота индуцировали в соломках льдообразование прикосновением охлажденным в жидком азоте пинцетом. Через 5 мин после этого соломки опускали в жидкий азот на хранение. Размораживание соломок проводили на водяной бане при 37 ° С. Функциональное состояние плазматических мембран оценивалось посредством изучения способности мембран переносить через себя воду, реагировать на гипотонические и гипертонические условия окружающей среды. Для этого 100 мкл нативной спермы смешивали: а) с 200 мкл дистиллированной воды (водяной тест); б) с 200 мкл раствора хлорида натрия с осмолярностью 150, 280, 510 мосм/кг. Через 5–10 мин после получения суспензии определялись показатели подвижности и морфологические изменения сперматозоидов. Искусственное повреждение плазматических мембран вызывали быстрым замораживанием, погружением суспензии сперматозоидов без криопротектора в жидкий азот. Для определения оптической плотности суспензии сперматозоидов равных концентраций при различных значениях осмолярности раствора хлорида натрия у 10 мужчин полученные суспензии анализировались на спектофотометре ХИТАЧИ -557 (Япония) при длине волны 530 нм в кварцевой кювете размерами 40' 15' 5 мм. Статистический анализ проведен с помощью программы STATISTICA. Результаты По данным подвижности после криоконсервации, условно выделены 2 группы: группа А (27 человек) – сперматозоиды с хорошей криорезистентностью – процент сохранившейся подвижности после криоконсервации больше 50% – 70,0±2,6; группа Б (23 человека) – сперматозоиды с плохой криорезистентностью – процент сохранившейся подвижности меньше 50% – 39,4±2,6. В гипоосмотических условиях (дистиллированная вода, 150 мосм/кг раствора хлорида натрия) хвостовая часть сперматозоидов имеет характерные морфологические изменения (набухание – swelling), отлично выявляемые в фазово-контрастном микроскопе (рис. 1). Рис. 1. Форма сперматозоидов в гипоосмотических условиях. Эти изменения происходят за счет проникновения воды через плазматическую мембрану и свидетельствует о полноценности плазматической мембраны хвостовой части сперматозоида. В нормоосмотических (280 мосм/кг раствора хлорида натрия) и гиперосмотических условиях (510 мосм/кг раствора хлорида натрия) таких выраженных видимых изменений хвостовой части сперматозоида не наблюдается (рис. 2). Рис. 2. Форма сперматозоидов в нормоосмотических и гиперосмотических условиях. При спектрофотометрии суспензии сперматозоидов в гипоосмотических условиях наблюдается уменьшение коэффицента плотности за счет морфологических изменений хвостовой части сперматозоида, а в гиперосмотических условиях увеличивается плотность суспензиии сперматозоидов за счет реакции головки сперматозоида. Тогда как при спектрофотометрии суспензии сперматозоидов с поврежденными мембранами с увеличением осмолярности раствора происходит уменьшение плотности суспензии сперматозоидов (рис. 3). Рис. 3. Зависимость плотности суспензии сперматозоидов от различных значений осмолярности раствора хлорида натрия. a – сперматозоиды с неповрежденными мембранами, б – сперматозоиды с поврежденными мембранами. В гипоосмотических условиях RAPID в группе А больше, чем в группе Б (рменьше 0,04). В гиперосмотических условиях в группе А в сравнении с группой Б выше процент подвижности (рменьше0,0001), VAP (рменьше0,01), VSL (рменьше0,03), VCL (рменьше0,01); RAPID (рменьше0,0005) (см. таблицу). Более достоверные различия наблюдаются при определении производного от деления показателя процента подвижности сперматозоидов в гиперосмотических условиях на процент подвижности в нормоосмотических условиях. Соответственно это производное составляет 0,87±0,03 (рменьше0,000002). Таким образом, исходя из полученных результатов, наиболее достоверным показателем криорезистентности является соотношение подвижности сперматозоидов в гиперосмотических и нормоосмотических условиях. Обсуждение Несмотря на то, что сперматозоиды человека по сравнению со сперматозоидами других млекопитающих наиболее устойчивы к криоконсервации, тем не менее после криоконсервации наблюдается значительная изменчивость выживаемости сперматозоидов. Определение процессов, ведущих к криорезистентности, имеет практическое значение, так как в настоящее время в связи с ростом мужского фактора в бесплодном браке актуально создание банка спермы не только доноров, но и мужчин, которые в силу своей деятельности могут подвергнуться влиянию неблагоприятных профессиональных факторов или которым предстоит вазоэктомии либо оперативное лечение по поводу заболевания с последующей лучевой и химиотерапией. Кроме того, в последнее время в связи с активным применением ИКСИ значительно увеличилось количество биопсийного материала из яичек, который необходимо сохранить для последующего применения. На выживаемость сперматозоидов после криоконсервации влияет много факторов, а именно: индивидуальное качество спермы, метод замораживания и размораживания, тип используемого криопротектора [4]. Одним из подходов к пониманию криорезистентности является изучение состояния плазматических мембран, так как они испытывают значительные нагрузки в процессе криоконсервации: при смешивании с криопротектором, при фазовых переходах лед–вода как при замораживании, так и при размораживании. Так, при добавлении гипертонического криопротектора клетки сжимаются. После проникновения криопротектора в цитоплазму клетки возвращаются к нормальному объему. В течение стадии замораживания клетки вновь сокращаются, так как вода покидает клетку вследствие замерзания внеклеточной воды и повышения концентрации солей (гиперосмолярность). Через все эти процессы клетки вновь проходят при размораживании. Обнаружено, что человеческие сперматозоиды могут набухать в 1,1 раза и сокращаться в 0,75 раза, при этом сохраняя свою функцию [5]. Поэтому представляет интерес изучение поведения сперматозоидов в экстремальных ситуациях, таких же, какие возникают при криоконсервации – в ситуации осмотического напряжения. С этой целью предлагается модель изучения поведения сперматозоидов в гипоосмотических и гиперосмотических условиях, так как при криоконсервации сперматозоиды оказываются в аналогичных условиях. Еще в 1934 г. основатель криоконсервации сперматозоидов В.К. Милованов высказал положение о стеносмотизме сперматозоидов млекопитающих, т.е. об их чувствительности к сравнительно небольшим изменениям осмотического давления в жидкой фазе спермы. Позже, в 60-е годы, И.В. Смирнов изучал осмотические явления в сперме животных [6]. Он нашел, что хвостовая часть подвижных бычьих сперматозоидов в гипотонических условиях характерно деформируется. В то же время у неподвижных сперматозоидов такой деформации не наблюдается. Отмечено, чем энергичнее движения сперматозоида, тем быстрее происходит деформация. Такие же явления, но у сперматозоидов человека обнаружены в 1984 г. [7], и в настоящее время ВОЗ, основываясь на этих данных, предлагает тест для оценки полноценности мембраны хвостовой части сперматозоида: HOST – hypoosmotic swelling test for sperm [8]. Предлагается также для оценки полноценности хвостовой части сперматозоида упрощенный вариант HOST – водяной тест [9]. В нашей работе изучалась подвижность сперматозоидов в гипоосмотических и гиперосмотических условиях. По результатам подвижности после криоконсервации выделены две группы – с хорошей и плохой криорезистентностью. В гипоосмотических условиях RAPID больше в той группе, где имеется хорошая криорезистентность. По другим показателям подвижности в этих же условиях (процент подвижности, VAP, VSL, VCL) достоверного различия в исследуемых группах нет. В гиперосмотических условиях наблюдается достоверная разница по всем показателям подвижности. В группе с хорошей криорезистентностью процент подвижности, VAP, VSL, VCL, RAPID больше, чем в группе с плохой криорезистентностью. Причем наиболее достоверное различие имеется по проценту подвижности. Надо отметить, что определение показателей подвижности с помощью компьютерного анализа (CASA – computer-aided sperm analysis) – в данном случае с помощью анализатора Hamilton Thorne – является объективным методом анализа. Поэтому данный метод имеет преимущество по сравнению с субъективным анализом в фазово-контрастном микроскопе. Следовательно, результаты, полученные с помощью анализатора Hamilton Thorne, заслуживают большего внимания. При сравнительном анализе полученных результатов с подобными результатами других авторов надо учитывать используемые методики как криоконсервации, так и применяемых для исследования тестов. Так, в 1998 г. изучалась взаимосвязь HOST, водяного теста и криорезистентности сперматозоидов от доноров спермы, мужчин с нормозооспермией и олигоастенозооспермией, состоящих в бесплодном браке. В этой работе для криоконсервации использовали отмытые от спермальной плазмы сперматозоиды, TEST – желточный криопротектор, криопробирки. Взаимосвязи результатов HOST, водяного теста и криорезистентности не обнаружено. На основании этого авторы делают вывод: так как эти тесты определяют полноценность хвостовой части сперматозоида, возможно, что криорезистентность, скорее всего, определяется не мембраной хвостовой части сперматозоида, а мембраной головки и другими цитоплазмо-метаболическими факторами [10]. Аналогичное заключение делается на основании разницы между результатами HOST и суправитального окрашивания сперматозоидов перед криоконсервацией и после нее [11]. Ранее было отмечено, что плазматические мембраны головки и хвостовой части сперматозоида различаются [12, 13]. Сопоставляя эти данные и тот факт, что в гиперосмотических условиях осмотическое напряжение испытывает больше головка сперматозоида, можно предположить важность исследования поведения сперматозоидов в гиперосмотических условиях, и найденная нами взаимосвязь полученных показателей подвижности в гиперосмотических условиях и криорезистентности представляется интересной. Что же касается изучения подвижности в гипоосмотических условиях, здесь определение подвижности в целом незначимо, а найденное различие в проценте быстрых сперматозоидов является любопытным и требует дальнейшего исследования. Таким образом, исходя из полученных результатов, можно предложить в качестве индивидуального теста криорезистентности сперматозоидов человека определение подвижности сперматозоидов в гиперосмотических условиях. Литература 1. Bunge R.G., Sherman J.K. Fertilizing capacity of frozen human spermatozoa. Nature 1953; 172: 767. 2. Watson P.E. Artifical insemination and the preservation of semen. In Lamming G.E. (ed.) Marshall¤s Physiology of Reproduction. Churchill Livingstone, Edinburgh, 1992; 2: 747–829. 3. Royere D., Barthe¤ Le¤ my C., Hamamah S., Lausac J. Cryopreservation of spermatozoa: a 1996 reviev. Human Reprod. Update, 1996; 2: 553–559. 4. Gilmore J.A., Liu J., Gao D.Y., Critser Y.K. Determination of optimal cryoprotectans and procedurs for their addition and removal from human spermatozoa. Hum Reprod 1997;1: 112–118. 5. Gao D.Y., Liu J., Liu C. Prevention of osmotic injury to human spermatozoa during addition and removal of glycerol. Hum Reprod 1995; 10: 1109–1122. 6. Смирнов И.В., Емец А.З. Осмотические явления в сперме животных. Животноводство 1971; 5: 80–8. 7. Jeyendran R.S., Van der Ven H.H., Perez-Pelaez M., Crabo B.G., Zaneveld J.D. J Reprod Fertil 1984; 70: 219–28. 8. Wold Health Organization. Laboratory manual for the examination of human semen and sperm-cervical mucus Interaction. 3 rd ed. New York: Cambridge University Press, 1993; 11. 9. Fuze H., Ohta S., Sakamoto M., Kazama T., Katayama T. The hypoosmotic swelling test with a medium of distilled water. Arch Androl 1993; 30: 111–6. 10. Lin M., Morshedi M., Srisombut C., Nassar A., Oehninger S. Plasma membrane integrity of cryopreserved human sperm(an investigation of the results of the hypoosmotic swelling test, the water test, and eosin-Y staining. Fertil Steril 1998; 70: 1148–1155. 11. Esteves S.C., Sharma R.K., Thomas A.J. Jr., Agarwal A. Suitability of the hypoosmotic swelling test for assessing the viability of cryopreserved sperm. Fertil Steril 1996; 66: 798–804. 12. Thorneycroft I., Bustillo M., Maric J. Donor fertility in an artifical insemination program. Fertil Steril 1984; 16: 144–145. 13. James P.S., Wolfe C.A., Mackic A., Ladha S., Prentice A., Iones R. Lipid dynamics in the plasma membrane of fresh and cryopreserved human spermatozoa. Hum Reprod 1999; 14: 1827–1832. Подвижность сперматозоидов в различных осмотических условиях в группе А (хорошая криорезистентность перматозоидов) и группе Б (плохая криорезистентность сперматозоидов)
Более достоверные различия наблюдаются при определении производного от деления показателя процента подвижности сперматозоидов в гиперосмотических условиях на процент подвижности в нормоосмотических условиях. Соответственно это производное составляет 0,87±0,03 (рменьше0,000002). Таким образом, исходя из полученных результатов, наиболее достоверным показателем криорезистентности является соотношение подвижности сперматозоидов в гиперосмотических и нормоосмотических условиях. Обсуждение Несмотря на то, что сперматозоиды человека по сравнению со сперматозоидами других млекопитающих наиболее устойчивы к криоконсервации, тем не менее после криоконсервации наблюдается значительная изменчивость выживаемости сперматозоидов. Определение процессов, ведущих к криорезистентности, имеет практическое значение, так как в настоящее время в связи с ростом мужского фактора в бесплодном браке актуально создание банка спермы не только доноров, но и мужчин, которые в силу своей деятельности могут подвергнуться влиянию неблагоприятных профессиональных факторов или которым предстоит вазоэктомии либо оперативное лечение по поводу заболевания с последующей лучевой и химиотерапией. Кроме того, в последнее время в связи с активным применением ИКСИ значительно увеличилось количество биопсийного материала из яичек, который необходимо сохранить для последующего применения. На выживаемость сперматозоидов после криоконсервации влияет много факторов, а именно: индивидуальное качество спермы, метод замораживания и размораживания, тип используемого криопротектора [4]. Одним из подходов к пониманию криорезистентности является изучение состояния плазматических мембран, так как они испытывают значительные нагрузки в процессе криоконсервации: при смешивании с криопротектором, при фазовых переходах лед–вода как при замораживании, так и при размораживании. Так, при добавлении гипертонического криопротектора клетки сжимаются. После проникновения криопротектора в цитоплазму клетки возвращаются к нормальному объему. В течение стадии замораживания клетки вновь сокращаются, так как вода покидает клетку вследствие замерзания внеклеточной воды и повышения концентрации солей (гиперосмолярность). Через все эти процессы клетки вновь проходят при размораживании. Обнаружено, что человеческие сперматозоиды могут набухать в 1,1 раза и сокращаться в 0,75 раза, при этом сохраняя свою функцию [5]. Поэтому представляет интерес изучение поведения сперматозоидов в экстремальных ситуациях, таких же, какие возникают при криоконсервации – в ситуации осмотического напряжения. С этой целью предлагается модель изучения поведения сперматозоидов в гипоосмотических и гиперосмотических условиях, так как при криоконсервации сперматозоиды оказываются в аналогичных условиях. Еще в 1934 г. основатель криоконсервации сперматозоидов В.К. Милованов высказал положение о стеносмотизме сперматозоидов млекопитающих, т.е. об их чувствительности к сравнительно небольшим изменениям осмотического давления в жидкой фазе спермы. Позже, в 60-е годы, И.В. Смирнов изучал осмотические явления в сперме животных [6]. Он нашел, что хвостовая часть подвижных бычьих сперматозоидов в гипотонических условиях характерно деформируется. В то же время у неподвижных сперматозоидов такой деформации не наблюдается. Отмечено, чем энергичнее движения сперматозоида, тем быстрее происходит деформация. Такие же явления, но у сперматозоидов человека обнаружены в 1984 г. [7], и в настоящее время ВОЗ, основываясь на этих данных, предлагает тест для оценки полноценности мембраны хвостовой части сперматозоида: HOST – hypoosmotic swelling test for sperm [8]. Предлагается также для оценки полноценности хвостовой части сперматозоида упрощенный вариант HOST – водяной тест [9]. В нашей работе изучалась подвижность сперматозоидов в гипоосмотических и гиперосмотических условиях. По результатам подвижности после криоконсервации выделены две группы – с хорошей и плохой криорезистентностью. В гипоосмотических условиях RAPID больше в той группе, где имеется хорошая криорезистентность. По другим показателям подвижности в этих же условиях (процент подвижности, VAP, VSL, VCL) достоверного различия в исследуемых группах нет. В гиперосмотических условиях наблюдается достоверная разница по всем показателям подвижности. В группе с хорошей криорезистентностью процент подвижности, VAP, VSL, VCL, RAPID больше, чем в группе с плохой криорезистентностью. Причем наиболее достоверное различие имеется по проценту подвижности. Надо отметить, что определение показателей подвижности с помощью компьютерного анализа (CASA – computer-aided sperm analysis) – в данном случае с помощью анализатора Hamilton Thorne – является объективным методом анализа. Поэтому данный метод имеет преимущество по сравнению с субъективным анализом в фазово-контрастном микроскопе. Следовательно, результаты, полученные с помощью анализатора Hamilton Thorne, заслуживают большего внимания. При сравнительном анализе полученных результатов с подобными результатами других авторов надо учитывать используемые методики как криоконсервации, так и применяемых для исследования тестов. Так, в 1998 г. изучалась взаимосвязь HOST, водяного теста и криорезистентности сперматозоидов от доноров спермы, мужчин с нормозооспермией и олигоастенозооспермией, состоящих в бесплодном браке. В этой работе для криоконсервации использовали отмытые от спермальной плазмы сперматозоиды, TEST – желточный криопротектор, криопробирки. Взаимосвязи результатов HOST, водяного теста и криорезистентности не обнаружено. На основании этого авторы делают вывод: так как эти тесты определяют полноценность хвостовой части сперматозоида, возможно, что криорезистентность, скорее всего, определяется не мембраной хвостовой части сперматозоида, а мембраной головки и другими цитоплазмо-метаболическими факторами [10]. Аналогичное заключение делается на основании разницы между результатами HOST и суправитального окрашивания сперматозоидов перед криоконсервацией и после нее [11]. Ранее было отмечено, что плазматические мембраны головки и хвостовой части сперматозоида различаются [12, 13]. Сопоставляя эти данные и тот факт, что в гиперосмотических условиях осмотическое напряжение испытывает больше головка сперматозоида, можно предположить важность исследования поведения сперматозоидов в гиперосмотических условиях, и найденная нами взаимосвязь полученных показателей подвижности в гиперосмотических условиях и криорезистентности представляется интересной. Что же касается изучения подвижности в гипоосмотических условиях, здесь определение подвижности в целом незначимо, а найденное различие в проценте быстрых сперматозоидов является любопытным и требует дальнейшего исследования. Таким образом, исходя из полученных результатов, можно предложить в качестве индивидуального теста криорезистентности сперматозоидов человека определение подвижности сперматозоидов в гиперосмотических условиях. В.И. Коренев, Е.А. Калинина, В.А. Лукин Кафедра акушерства и гинекологии Московской медицинской академии им. М.И. Сеченова отделение ЭКО Клиники планирования семьи Литература 1. Bunge R.G., Sherman J.K. Fertilizing capacity of frozen human spermatozoa. Nature 1953; 172: 767. 2. Watson P.E. Artifical insemination and the preservation of semen. In Lamming G.E. (ed.) Marshall¤s Physiology of Reproduction. Churchill Livingstone, Edinburgh, 1992; 2: 747–829. 3. Royere D., Barthe¤ Le¤ my C., Hamamah S., Lausac J. Cryopreservation of spermatozoa: a 1996 reviev. Human Reprod. Update, 1996; 2: 553–559. 4. Gilmore J.A., Liu J., Gao D.Y., Critser Y.K. Determination of optimal cryoprotectans and procedurs for their addition and removal from human spermatozoa. Hum Reprod 1997;1: 112–118. 5. Gao D.Y., Liu J., Liu C. Prevention of osmotic injury to human spermatozoa during addition and removal of glycerol. Hum Reprod 1995; 10: 1109–1122. 6. Смирнов И.В., Емец А.З. Осмотические явления в сперме животных. Животноводство 1971; 5: 80–8. 7. Jeyendran R.S., Van der Ven H.H., Perez-Pelaez M., Crabo B.G., Zaneveld J.D. J Reprod Fertil 1984; 70: 219–28. 8. Wold Health Organization. Laboratory manual for the examination of human semen and sperm-cervical mucus Interaction. 3 rd ed. New York: Cambridge University Press, 1993; 11. 9. Fuze H., Ohta S., Sakamoto M., Kazama T., Katayama T. The hypoosmotic swelling test with a medium of distilled water. Arch Androl 1993; 30: 111–6. 10. Lin M., Morshedi M., Srisombut C., Nassar A., Oehninger S. Plasma membrane integrity of cryopreserved human sperm(an investigation of the results of the hypoosmotic swelling test, the water test, and eosin-Y staining. Fertil Steril 1998; 70: 1148–1155. 11. Esteves S.C., Sharma R.K., Thomas A.J. Jr., Agarwal A. Suitability of the hypoosmotic swelling test for assessing the viability of cryopreserved sperm. Fertil Steril 1996; 66: 798–804. 12. Thorneycroft I., Bustillo M., Maric J. Donor fertility in an artifical insemination program. Fertil Steril 1984; 16: 144–145. 13. James P.S., Wolfe C.A., Mackic A., Ladha S., Prentice A., Iones R. Lipid dynamics in the plasma membrane of fresh and cryopreserved human spermatozoa. Hum Reprod 1999; 14: 1827–1832. |