Частота нерасхождения хромосом в половых клетках пациентов с нарушением репродуктивной функции
|
Оценка состояния сперматогенеза имеет важное диагностическое значение при различных формах нарушения репродуктивной функции. С этой целью разработан ряд методов, основанных на исследовании морфологии и состава по стадиям развития половых клеток. Традиционный спермиологический анализ является начальным звеном в цепи лабораторных исследований и позволяет судить о количестве сперматозоидов, их подвижности, жизнеспособности и морфологии, наличии незрелых половых клеток [1]. Однако данный метод не дает полной картины состояния каждой из стадий гаметогенеза.
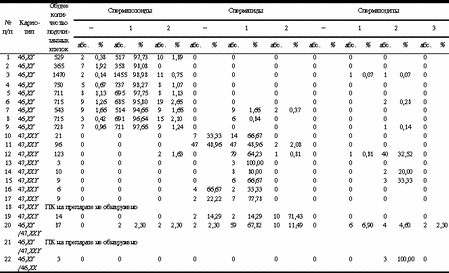
Анализ гистопрепаратов биоптата яичка позволяет более глубоко и полно оценить состояние сперматогенеза. Наряду с преимуществами метод не лишен недостатков, так как процедура биопсии может сопровождаться различными осложнениями (например, развитием аутоиммунных процессов), поэтому показания к биопсии весьма ограничены. Среди недостатков метода следует отметить возможность анализа только фрагмента одного яичка. Чтобы исключить негативные моменты, связанные с проведением биопсии, и получить исчерпывающую информацию о состоянии сперматогенеза у пациентов, для которых проведение биопсии яичка не показано (примерно / от числа всех обследуемых), в практику исследователей введен метод количественного кариологического анализа состава незрелых половых клеток (ККА НПК) эякулята, разработанный в лаборатории генетики нарушений репродукции Медико-генетического научного центра РАМН. Этот метод основан на исследовании состава по стадиям развития незрелых половых клеток (НПК), доля которых в эякуляте здорового мужчины составляет 2-4% от общего количества половых клеток (ПК) и имеет тенденцию к росту при различных патологических состояниях [2, 3]. Являясь абсолютно безопасным для пациента, этот метод не имеет ограничений по показаниям и дает возможность постадийной оценки состояния сперматогенеза. ККА НПК можно проводить многократно. Этот анализ отражает изменения в гаметогенезе при оценке эффективности лечения [4, 5]. Вышеперечисленные методы в достаточной мере характеризуют морфофизиологию гаметогенеза. И в некоторых случаях исследователи ограничиваются их применением в целях диагностики и контроля состояния генеративной функции. Например, в случае анализа влияния инфекционного процесса на сперматогенез. Причины патологических изменений генеративной функции яичек различны. Нарушение функции системы репродукции может быть генетически обусловлено [6-8]. За последние несколько лет были картированы гены, продукты которых регулируют развитие и функцию гонад. Описаны мутации в генах, приводящие к нарушению процесса гаметогенеза [9, 10]. Известно, что хромосомные аномалии (ХА) также едут к нарушению репродуктивной функции. Среди хромосомопатий специалисты различают структурные и числовые ХА. В общей популяции уровень ХА невелик и составляет 0,5-3,0%, в то время как среди пациентов с нарушением фертильности доля лиц с ХА возрастает до 7-10%, а, например, среди мужчин с азооспермией достигает 20% [8, 11-15]. Эти данные указывают на необходимость цитогенетического исследования у пациентов с нарушением репродуктивной функции. Также необходимо исследовать хромосомный набор ПК для исключения гонадного мозаицизма. В случае выявления последнего следует провести расчет риска рождения ребенка с наследственной патологией. Цитогенетическое исследование незрелых гамет на разных стадиях их развития у мужчин проблематично вследствие относительной трудности получения материала. При биопсии яичка возможен анализ хромосом ПК, находящихся на определенных стадиях своего развития (сперматоциты на стадии пахитены, диакинеза-метафазы I, метафазы II), но биопсия яичка показана лишь для узкой группы пациентов с а- и олигозооспермией III степени [16]. Работа с ядрами ПК для анализа хромосом была начата в 70-х годах прошлого столетия. В 1978 г. в научную практику вошел метод гетерологичного оплодотворения ооцитов золотистого хомячка сперматозоидами человека, позволивший анализировать хромосомы сперматозоидов человека [17]. В 90-х годах XX века был разработан метод флюоресцентной гибридизации in situ (FISH), при котором возможно анализировать ХА в ядрах не только клеток, находящихся на стадии метафазы, но и интерфазных соматических и ПК [6, 18, 19]. Целью настоящего исследования явилось определение частоты нерасхождения хромосом при анализе методом FISH анеуплоидии хромосом I, X и Y в ПК из эякулята мужчин в бесплодном браке. Материал и методы Обследованы 23 пациента, в том числе в качестве условно контрольной (первой) группы 10 мужчин с нормальным кариотипом и нормозооспермией и 13 пациентов с кариотипом 47,XXY (из них 3 - с мозаичной формой синдрома Клайнфельтера) и азооспермией (вторая группа). В схему клинико-генетического обследования входило спермиологическое исследование эякулята, количественный кариологический анализ НПК из эякулята, цитогенетическое исследование лимфоцитов периферической крови, молекулярно-цитогенетическое исследование препаратов клеток эякулята (FISH). Спермиологический анализ эякулята выполняли по методу, предложенному ВОЗ [1]. Суховоздушные препараты получали общепринятыми методами и окрашивали красителем Гимза для проведения количественного анализа состава НПК по разработанному нами способу [4]. Цитогенетическое исследование проводили на препаратах метафазных хромосом лимфоцитов периферической крови, культивируемых в условиях in vitro, в соответствии со стандартной процедурой [43]. G-окраску хромосом проводили по общепринятому методу Seabright [44] в модификации [45]. Препараты ПК эякулята для FISH-анализа готовили по M. Guttenbach и соавт. [18, 19]. FISH проводили по методу, разработанному проф. Ю.Б. Юровым [21, 22] и д-ром И.В. Соловьевым [20]. Использовали ДНК-пробы, специфичные для гоносом (XY) и хромосомы 1. При этом были использованы a-сателлитные пробы MG-1-04 (1q12), MGY-01 (Y cen), MGX-01 (X cen). Проанализированы 11 742 ПК, из них 4684 - с использованием ДНК-проб, специфичных для гоносом; и 7058 - с использованием ДНК-проб, специфичных для хромосомы 1. В исследовании применяли хромосомоспецифичные ДНК-пробы из оригинальной библиотеки лаборатории цитогенетики Научного центра психического здоровья РАМН [20-22]. Результаты и обсуждение Выявлен высокий уровень дисомии хромосом X, Y и 1 в мужских ПК (как в сперматозоидах, так и в сперматидах; табл. 1, 2). Так, 0,75-2,65% ядер ПК индивидов с нормозооспермией дисомны по хромосоме 1. Доля ПК, имеющих дисомию по хромосоме X, составляет 0-3,62%; по хромосоме Y - 0-5,58%. Определен высокий уровень XY-несущих сперматид и сперматозоидов в данной группе пациентов (с нормозооспермией и нормальным кариотипом): от 2,15 до 5,71%. Наши результаты согласуются с результатами, полученными A. Goldman и соавт.: доля ядер ПК, имеющих дисомию по хромосоме Х, составляла 0,8%, дисомию по хромосоме Y - 1,3%, XY-несущих - 2,27% [23]. Таблица 1. Результаты FISH-анализа с использованием ДНК зондов, специфичных для хромосомы
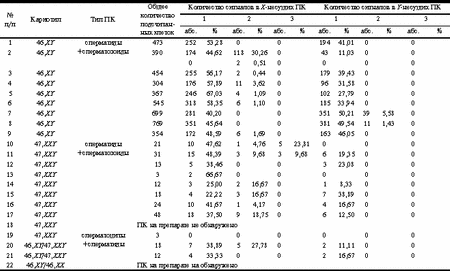
Таблица 2. Результаты двуцветового FISH-анализа с использованием ДНК-зондов, специфичных для гоносом
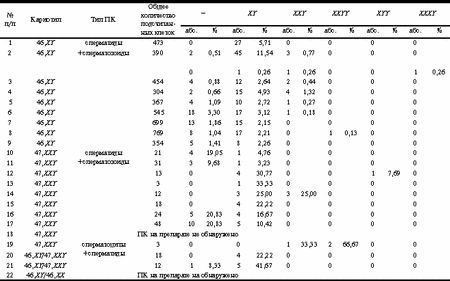
Продолжение табл. 2
Данные по этому вопросу, представленные другими авторами, многообразны и противоречивы. В исследовании E. Spriggs и соавт. уровень дисомии по хромосоме 1 в сперматозоидах составил 0,10%, доля ХХ-, YY- и XY-несущих сперматозоидов достигает - 0,07, 0,21, 0,15% соответственно [24]. По данным B. Brandriff и I. Gordon, частота дисомии хромосомы 1 в ядрах сперматозоидов составляет 0,17%, хромосомы Y - 0,03% [25]. По M. Pieters и соавт., уровень дисомии хромосомы 1 среди ПК равняется 0,80% [26]. Согласно A. Joseph и соавт., доля сперматозоидов, имеющих нерасхождение по хромосоме 1, составляет 0,35%, по хромосоме Y - 0,18% [27]. Среди мужчин с бесплодием и нарушением сперматогенеза 7-10% являются носителями различных типов ХА [8, 11, 15, 28, 29]. Специалисты выделяют числовые и структурные ХА. На долю числовых ХА в случае мужчин с бесплодием приходится около 60% всех ХА; из них 28% составляют аберрации аутосом. Значительная часть (32%) принадлежит числовым аномалиям гоносом [8, 11, 28, 30]. Вопрос о числовых ХА ПК широко освещается в научной литературе. Большинство ПК, имеющих ХА, дегенерируют в ходе сперматогенеза и не участвуют в оплодотворении. Однако, как показано в обзоре [19], до 5% всех сперматозоидов эякулята здоровых доноров несут числовые ХА. Уровень нерасхождения неодинаков для каждой из хромосом. Согласно данным разных авторов, наибольшая частота дисомии в сперматозоидах отмечена для хромосомы 1 (0-0,96%) и гоносом, т.е. хромосом X и Y (0-0,70%) [19, 31-34]. Авторы обсуждают причины возникновения дисомии хромосом, в числе которых указывают повреждение механизма образования веретена деления, функции микротрубочек, и, как следствие, нарушение расхождения хромосом в делениях созревания. P. Hummelen и соавт. отмечают, что связанные с микротрубочками белки, вовлеченные в формирование веретена деления и расхождение хромосом, играют роль и в движении сперматозоидов. Полипептиды, формирующие данные белки, кодируются различными генами, и мутации, поражающие даже один из них, приводят к анеуплоидии и изменяют подвижность сперматозоидов [31]. C. Giorlandino и соавт. показали, что, имея большую скорость и подвижность, анеуплоидные сперматозоиды успешнее оплодотворяют яйцеклетки человека. Это, в свою очередь, может служить причиной увеличения частоты развития эмбрионов с анеуплоидией, приводящей к спонтанным абортам [35]. Одним из предполагаемых факторов, влияющих на нерасхождение хромосом группы A, можно считать размер хромосом. Однако в обзоре [18] говорится о том, что размер хромосом не является причиной повышения частоты их нерасхождения. На этот процесс предположительно влияют морфология хромосом и их специфическая характеристика (наличие регионов ядрышкового организатора, количество гетерохроматина). Так, высокая частота дисомии хромосомы 1 по сравнению с другими аутосомами может быть связана с наличием большого гетерохроматинового сегмента на q-плече хромосомы. Исследователи выявили тенденцию к увеличению частоты гипергаплоидии для хромосом, несущих большие перицентромерные гетерохроматиновые участки [24]. И структурные, и числовые ХА сперматозоидов часто являются причиной бесплодия, спонтанных абортов (СА), ранней детской смертности, наличия врожденных пороков развития, умственной отсталости, аномалий поведения и т.д. Приблизительно 50% спонтанных абортов связаны с ХА, из числа которых 26% - по причине анеуплоидии у абортусов. 0,5% новорожденных имеют ХА; у 0,3% обнаруживают трисомию аутосом и анеуплоидию половых хромосом [18]. Другими словами, наличие дисомии по той или иной хромосоме является одной из причин СА, рождения детей с множественными врожденными пороками развития, а также случаев бесплодия неясного генеза, когда СА происходит практически бессимптомно на самых ранних стадиях развития эмбриона. Ранее нами описан случай нерасхождения хромосомы 1 [36]. При нормальном кариотипе (46,XY) и наличии нормозооспермии, по данным ККА НПК, у пациента наблюдался блок сперматогенеза на стадии пахитены-диплотены. С помощью FISH-анализа в сперматозоидах выявлена дисомия хромосомы 1, что может служить вероятной причиной бесплодия этой супружеской пары. В настоящем исследовании обнаружен случай высокой частоты нерасхождения хромосомы Х (случай №2, см. табл. 2). В сперматозоидах этого пациента уровень дисомии по хромосоме 1 составил 1,13%, в то время как доля клеток с нерасхождением хромосомы Х - 30,26%; клеток, дисомных по хромосоме Y, не выявлено. В анамнезе супруги данного пациента отмечены СА на разных сроках беременности. При этом показатели семиологического анализа этого пациента находились в пределах нормы, и кариотип соответствовал нормальному мужскому (46,XY). Одной из причин хромосомопатий эмбрионов является внесение в зиготу мужской или женской ПК лишней хромосомы при оплодотворении. Другая причина — нарушение расхождения хромосом при дроблении эмбриона. Значительную часть нарушений репродуктивной функции мужчин составляют анеуплоидии гоносом. Наиболее частой их формой является синдром Клайнфельтера. Среди мужчин с бесплодием этот синдром выявляется у 10-15% [37]. У некоторых индивидуумов с кариотипом 47,XXY и 46,XY/47,XXY процесс дифференцировки и созревания ПК (сперматогенез) может протекать вплоть до заключительных стадий, заканчиваясь развитием сперматозоидов [36, 38], хотя у абсолютного большинства пациентов с таким диагнозом отмечена азооспермия или олигозооспермия тяжелой степени. Нами проведен FISH-анализ с целью определения частоты дисомии хромосом 1, X, и Y в ПК пациентов данной группы. Это позволило составить представление о частоте и причинах нерасхождения хромосом в их гаметах. Исследованы ПК 12 пациентов с синдромом Клайнфельтера (в 3 случаях - мозаичная форма). При молекулярно-цитогенетическом анализе частоты нерасхождения хромосомы Х в случае мозаицизма дисомия выявлена в 27,78% сперматид и сперматозоидов (случай №20, см. табл. 2). Для другого пациента (случай №21, см. табл. 2) дисомия хромосомы X не выявлена. Доля XY-несущих сперматид (нарушение расхождения гоносом в мейозе в ходесперматогенеза) составила 22,22 и 41,67% для этих 2 пациентов (случаи №20, 21) соответственно. У пациентов с кариотипом 47,XXY частота дисомии хромосомы Х в сперматидах и сперматозоидах (если таковые обнаружены) колебалась от 0 до 18,75%. При этом доля XY-несущих сперматид и сперматозоидов находилась в пределах 0-33,33%. Tаким образом, уровень дисомии в ПК у пациентов с синдромом Клайнфельтера выше такового у индивидуумов с нормальным кариотипом. У 2 пациентов данной группы (случаи №10, 11, см. табл. 2) в 23,81 и 9,68% сперматид соответственно выявлены по 3 гибридизационных сигнала, свидетельствующие о наличии трисомии по хромосоме X. Наряду с этим у некоторых обследуемых (случаи №12, 14) обнаружены сперматиды с триплоидией гоносом, т.е. в случае №12 определены две хромосомы Y и 1 хромосома X в одном ядре, в случае №14 - одна хромосома Y и две хромосомы X, что составило 7,69 и 25,00% ПК соответственно. При исследовании эякулята одного из пациентов (случай №19, см. табл. 2) обнаружены лишь 3 ПК (сперматоциты), имеющие аномальный кариотип (см. табл. 2), что свидетельствует о глубоком нарушении и подавлении сперматогенеза. Для пациентов с кариотипом 47,XXY на фоне повышенного уровня нерасхождения хромосом доля сперматид и сперматозоидов, дисомных по хромосоме 1, определялась в пределах 0,81-71,43%. В подавляющем большинстве случаев уровень нерасхождения по хромосоме 1 сравним с таковым для пациентов с кариотипом 46,XY (см. табл. 1). Также нами выявлено большое количество ПК, не содержащих метку (0-66,67 и 0-20,83%), при использовании зондов, специфичных соответственно для хромосом X и Y. Это можно объяснить наличием дегенерирующих и, следовательно, не включивших метку клеток, особенно в случае пациентов с синдромом Клайнфельтера. Однако это может являться показателем, характеризующим долю ПК, имеющих нулисомию по перечисленным хромосомам. Полученные нами данные подтверждают необходимость проведения молекулярно-цитогенетической диагностики у пациентов с нарушением репродуктивной функции. Результаты исследований кариотипа пациента с помощью различных методов неоднозначны и противоречивы. Существуют ситуации, когда при кариотипировании лимфоцитов классическим цитогенетическим методом устанавливается кариотип 47,XXY. Однако при применении FISH-метода специалисты выявляют наличие мозаицизма (46,XY/47,XXY) у того же пациента на том же материале (лимфоциты периферической крови), поскольку при FISH-анализе имеется возможность исследования большего количества клеток [39]. Наличие скрытого мозаицизма, возможно, объясняет полиморфизм клинического проявления синдрома Клайнфельтера.Некоторые индивидуумы с нарушением репродуктивной функции являются кандидатами на ЭКО, ИКСИ. При этом отмечен повышенный уровень ХА у пациентов, прибегнувших к услугам репродуктивных технологий. Так, известно, что среди 1210 мужчин, имеющих отклонения показателей в спермограмме, при анализе хромосом лимфоцитов периферической крови у 3,6% выявлены ХА [40]. По данным литературы, из 261 обследованной супружеской пары, проходившей курс ИКСИ, у 4,2% мужчин и 1,2% женщин обнаружены аномалии хромосом: у 3% мужчин и 0,7% женщин выявлены хромосомные транслокации, у 0,7% индивидов мужского и 0,4% женского пола - инверсии хромосом. Среди 8 плодов от супружеских пар с ХА 3 из 5 и 2 из 3 унаследовали ХА от отца или матери. В беременностях, развившихся после ЭКО в парах с нормальным кариотипом, у плодов не выявлены ХА. Установлено отсутствие различий в частоте оплодотворения среди пар с аномальными и нормальными кариотипами [41, 42]. Исследователи рекомендуют проведение медико-генетического консультирования и цитогенетического анализа для мужчин с тяжелыми формами олигозооспермии до проведения ИКСИ; генетическое консультирование в случае необходимости должно включать последующую пренатальную диагностику [8, 40]. Это актуально и при криоконсервации гамет с последующей их донацией. Необходимость цитогенетического обследования пациентов до проведения процедуры ИКСИ очевидна, так как риск передачи потомству генетической, в том числе и хромосомной, патологии от родителя очень высок. Совершенствование схем медико-генетического консультирования, необходимость его проведения при обследовании пациентов с нарушениями репродуктивной функции, применение современных методов исследования, в том числе молекулярных, молекулярно-генетических и молекулярно-цитогенетических, является важной задачей в условиях широкого применения репродуктивных технологий. А.П. Савельева, Л.Ф. Курило, Л.В. Шилейко, Г.И. Козлов, С.Ю. Калинченко, В.О. Шаронин, Ю.Б. Юров, С.Г. Ворсанова Медико-генетический научный центр РАМН, Научный центр психического здоровья РАМН, Московский НИИ педиатрии и детской хирургии Минздрава РФ Литература 1. WHO Laboratory manual for the examination of human semen and sperm-cervical mucus interaction. Cambridge University press 1992; 107. 2. Курило Л.Ф., Любашевская И.А., Дубинская Р.П., Гаева Т.Н. Кариологический анализ состава НПК эякулята. Урология и нефрология 1993; 2: 45-47. 3. Курило Л.Ф., Дубинская Р.П., Остроумова Т.В., Шилейко Л.В. Оценка сперматогенеза по НПК эякулята. Пробл репрод 1995; 3: 33-37. 4. Курило Л.Ф., Любашевская И.А., Дубинская В.П. и др. Количественный кариологический анализ состава незрелых половых клеток из эякулята. Урология и нефрология 1993; 5: 45-47. 5. Курило Л.Ф., Шилейко Л.В., Остроумова Т.В. Возможности цитологической количественной оценки состояния сперматогенеза по незрелым половым клеткам из эякулята пациентов с проблемами деторождения. Бизнес-медици на Мобиле 1998; 3: 12-13. 6. Yurov Y.B., Saias M.J., Vorsanova S.G. et al. Rapid chromosomal analysis of germ - line cells by FISH: an investigation of infertile male with large - head spermatozoa. Molec Hum Reprod 1996; 2: 9: 665-668. 7. Barakat A.I., Seikaly M.G., Kaloustian V.M. Urogenital abnormalities in genetic disease. J of Urology 1986; 136: 4: 778-785. 8. Курило Л.Ф., Шилейко Л.В., Сорокина Т.М., Гришина Е.М. Структура наследственных нарушений репродуктивной системы. Вест РАМН 2000; 5: 32-36. 9. Курило Л.Ф., Черных В.Б. Генетический контроль дифференцировки пола у человека. Тез. докл. II (IV) съезда российского общества медицинских генетиков. Курск 2000; 1: 64. 10. Коптева А.В., Дзенис И.Г., Бахарев В.А. Генетические нарушения гипоталамо-гипофизарной регуляции репродуктивной системы. Пробл репрод 2000; 6: 3: 28-35. 11. Курило Л.Ф., Шилейко Л.В., Мхитарова Е.В. и др. Структура наследственной патологии половой системы при обследовании пациентов с нарушением репродукции. Тез. докл. Рос. конф. «Медико-генетическое консультирование в профилактике наследственных болезней». М 1997; 155-156. 12. Bourrouillou G., Dastuque N., Colombies P. Chromosome studies in 952 infertile males with a sperm count below 10 mln/ml. Hum Genet 1985; 71: 366-367. 13. Retief A.E., Van Zyl J.A., Menkveld R., Fox M.F. Chromosome studies in 496 infertile males with a sperm count below 10 mln/ml. Hum Genet 1984; 66: 162-164. 14. Rivas F., Garcia-Esquivel L. Cytogenetic evaluation of 163 azoospermics. J Hum Genet 1987; 35: 4: 291-298. 15. Курило Л.Ф., Шаповал Н.В., Дубинская В.П. и др. Структура хромосомной патологии среди пациентов с нарушением репродуктивной системы. Тез. докл. 1 (3) Рос. съезда мед. генетиков. М 1994; 1: 85-86. 16. Курило Л.Ф., Чеботарев А.Н., Шилейко Л.В., Остроумова Т.В. Сравнительный анализ соотношения НПК на разных стадиях их дифференцировки в биоптате яичка и эякуляте у пациентов с азоо- и олигозооспермией. Пробл репрод 1997; 1: 80-84. 17. Rudak E., Jacobs P.A., Yanagimachi R. Derect analysis of the chromosome constitution of human spermatozoa. Nature 1978; 274: 911-913. 18. Guttenbach M., Engel V., Schmid M. Analysis of structural and numerical chromosome abnormalities in sperm of normal men and carriers of constitutional chromosome aberrations. A review. Hum Genet 1997; 100: 1: 1-21. 19. Guttenbach M., Schakowski R., Schmid M. Incidence of chromosome 3, 7, 10, 11, 17 and X disomy in mature human sperm nuclei as determined by nonradioactive in situ hybridization. Hum Genet 1994; 93: 1: 7-12. 20. Soloviev I.V., Yurov Y.B., Ioannou P., Georghiou A. et al. Identification and molecularcytogenetic characterization of large subset of human plasmids, cosmids, PAC and YAC clons: the search of DNA probes for pre- and postnatal diagnosis. Cs Pediat 1997; 52: 7: 529-538. 21. Yurov Y., Soloviev I., Vorsanova S. et al. DNA probes for pre-and postnatal diagnosis of chromosomal anomalies: collection for FISH analysis. Cs Pediat 1997; 52: 7: 550-554. 22. Yurov Y., Soloviev I., Vorsanova S. High resolution multicolor fluorescense in situ hybridisation using cyanine and fluorescein dyes: rapid chromosome identification by directly fluorescently labeled alphoid DNA probes. Hum Genet 1996; 97: 390-398. 23. Goldman A.Sh., Fomina Z. Analysis of the primery sex ratio sex chromosome aneuploidy and diploidy in human sperm using dual-color FISH. Eur J Hum Genet 1993; 1: 325-334. 24. Spriggs E.L., Rademarker A.W., Martin R.H. Aneuploidy in human sperm result of two-color FISH testing centromeric probes for chromosome 1, 12, 15, 18, X, Y. Cytogenet Cell Genet 1995; 71: 47-53. 25. Brandriff B.F., Gordon I.A. Human sperm cytogenetics and the one cell zygote. In: Allen J.W. (ed). Mutation induction and heritability in mammalian germ cells (Banbury report 34). NY: Cold Spring Harbor 1990; 183-194. 26. Pieters M.N.E.C., Geraeds J.P.M., Meyer H. Human gametes and zygotes studies by nonradioactive in situ hybridization. Cytogenet Cell Genet 1990; 53: 15-19. 27. Joseph A.M., Gosden J.R., Chandley A.C. Estimation of aneuploidy levels in human spermatozoa using chromosome specific probes and in situ hybridization. Hum Genet 1984; 66: 234-238. 28. Курило Л.Ф. Доля генетической патологии у пациентов с нарушением развития половой системы. Сб-к: Лекции для врачей. Сексопатология и андрология, вып. 4. Киев 1998; 18-27. 29. Koulischer L., Schoysman R. Chromosomes and human infertility.Mitotic and meiotic chromosome studies in 202 consecutive male patients. Clinical Genetics 1974; 5: 2: 116-126. 30. Ворсанова С.Г., Шаронин В.О., Курило Л.Ф. Аномалии половых хромосом при нарушении репродуктивной функции у мужчин. Пробл репрод 1998; 4: 2: 12-21. 31. Hummelen P., Lowe R., Wyrobek A.J. Simultaneous detection of structural and numerical chromosomes abnormalities in sperm of healthy men by multicolor fluorescence in situ hybridization. Hum Genet 1996; 98: 608-615. 32. Martin R.H. Genetics of human sperm. J of assisted reproduction and genetics 1998; 15: 5: 240-245. 33. Martin R.H., Spriggs E. The relationship between paternal age, sex ratios and aneuploidy frequencies in human sperm as assested by multicolor FISH. Am J Hum Genet 1995; 57: 1395-1399. 34. Miharu N., Best G. Numerical chromosome abnormalities in spermatozoa of fertile and infertile men detected by FISH. Hum Genet 1994; 93: 502-506. 35. Giordino C., Calugi G., Iaconiani L. Spermatozoa with chromosomal abnormalities may resulting in a higher rate of reccurent abortions. Fertil Steril 1998; 70: 3: 576-577. 36. Шаронин В.О. Роль молекулярно-цитогенетических исследований хромосомных аномалий соматических и половых клеток при нарушении репродуктивной системы у пациентов мужского пола. Автореф. дис. ... канд. биол. наук. 1998; 24. 37. Маринчева Г.С., Гаврилов В.И. Умственная отсталость при наследственных болезнях. М: Медицина 1988; 255. 38. Гаева Т.Н. Разработка метода количественного анализа незрелых половых клеток из эякулята и выяснение степени его информативности. Автореф. дис. ... канд. биол. наук 1997; 16. 39. Ворсанова С.Г., Юров Ю.Б. Молекулярно-цитогенетическая пре- и постнатальная диагностика хромосомной патологии. Вест РАМН 1999; 11: 12-15. 40. Pandiyan N., Jequier A. Meiotic structural chromosomal abnormalities of 1210 infertile males. Hum Reprod 1996; 11: 12. 41. Bergere M., Selva J., Volante M., Dumont M. Cytogenetic analysis of uncleaved oocytes after ICSI. J of assisted reproduction and genetics 1995; 12: 5. 42. Testart J., Gauter E., Branu C. et al. ICSI of infertile patients with structural chromosomal abnormalities. Hum Reprod 1996; 11: 12. 43. Hungerford D.A. Leukocytes cultured from small inocula of whole blood and preparation of metaphase chromosomes by treatment with hypotonic KCl. Stain Techn 1965; 40: 333-338. 44. Seabright M., Cook P., Wheeler M. Variation in trypsin banding at different stages of contraction in human chromosomes and the definition, by measurement, of the "average" karyotype. Hum Genet 1971; 29: 35-40. 45. Захаров А.Ф., Бенюш В.А., Кулешов Н.П. Хромосомы человека. М: Медицина 1982; 263. |