Сравнительная оценка эффективности трансдермальной и пероральной ЗГТ
|
Сердечно-сосудистые заболевания сегодня являются основной причиной смертности у женщин в развитых странах. В Европе, США, Австралии в 10 раз больше женщин умирают от сердечно-сосудистых заболеваний, чем от рака молочной железы [4].
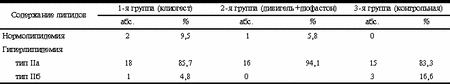
Многочисленные эпидемиологические исследования показали, что дефицит эстрогенов в менопаузе является основной причиной возрастания частоты сердечно-сосудистых заболеваний у женщин в этом периоде жизни, а заместительная гормонотерапия (ЗГТ) эстрогенами снижает риск возникновения сердечно-сосудистых заболеваний на 30—50% [2, 3, 5, 8, 12]. Среди механизмов реализации кардиопротективного эффекта эстрогенов на долю изменений липидного спектра крови под воздействием ЗГТ приходится от 20 до 50% [1, 12]. Влияние ЗГТ на липидный спектр крови зависит от типа гормонов (эстрогена и прогестерона), дозы и пути введения. Различают два основных пути введения гормонов: ентеральный — сублингвальный и пероральный; парентеральный — чрескожный (пластырь, гель), вагинальный (мазаи, свечи, кольца), назальный, инъекционный (подкожный, внутримышечный, внутривенный), внутриматочный (спирали). Целью работы явилась сравнительная оценка эффективности различных способов введения гормонов (трансдермального и перорального) на липидный спектр крови у женщин в постменопаузе. Материал и методы В исследование включено 56 женщин в возрасте 46—67 лет (средний возраст 56,8±5,26 года) с продолжительностью постменопаузы от 2 до 18 лет (8,7±5,41 года), индексом массы тела от 19 до 36 (26,3±3,58). Все пациентки были разделены на 3 группы: в 1-ю группу входила 21 пациентка, получавшая монофазную оральную терапию 17b-эстрадиолом 2 мг и норэтистероном ацетата 1 мг (клиогест) в непрерывном режиме; во 2-ю группу — 17 пациенток, получавших монофазную комбинированную терапию гелем, содержащим 1 мг трансдермального эстрадиола (дивигель) и 5 мг дидрогестерона (дюфастон) в непрерывном режиме; в 3-ю группу (контрольную) — 18 пациенток, не получавших гормонотерапию. Подбор типа ЗГТ проводился методом случайной выборки. Период наблюдения составил 12 мес. Всем пациенткам до начала лечения было проведено общеклиническое обследование: трансвагинальное ультразвуковое сканирование органов малого таза, маммография, биохимический анализ крови (почечно-печеночные пробы), общий анализ крови. Состояние липидного спектра крови оценивали исходно и через год от начала терапии по основным общепринятым показателям: общему холестерину (ХС), холестерину липопротеидов низкой плотности (ХС ЛПНП), холестерину липопротеидов очень низкой плотности (ХС ЛПОНП), холестерину липопротеидов высокой плотности (ХС ЛПВП), количеству триглицеридов (ТГ), содержанию апопротеидов апоА-1 и апоВ и коэффициенту атерогенности ЛПНП/ЛПВП и апоВ/апоА-1. Статистический анализ данных проводился с помощью пакета программ Excel 7.0. С целью определения значимости (достоверности) различий сопоставляемых средних величин применен критерий Стьюдента (t). При этом разница средних величин считалась достоверной при р<0,05 (95% уровень значимости). Результаты исследований Основные антропометрические показатели и данные анамнеза у обследуемых женщин представлены в табл. 1. Таблица 1. Основные антропометрические показатели и данные анамнеза у обследуемых женщин (средние значения ±SD)
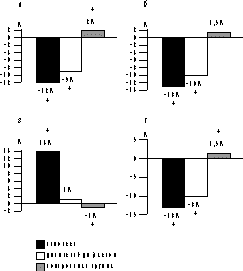
Исходный липидный профиль у женщин обследуемых групп представлен в табл. 2. У подавляющего числа женщин выявляется, согласно классификации ВОЗ, IIа тип гиперлипидемии, характеризующийся повышенным уровнем ХС ЛПНП и нормальным или повышенным уровнем общего ХС. Группы обследованных женщин были сопоставимы по основным антропометрическим и анамнестическим данным и данным липидного спектра крови. Изменения уровня липидов и липопротеидов на фоне проводимой терапии показаны на рисунке. По окончании периода наблюдений в обеих исследуемых группах отмечено достоверное антиатерогенное воздействие ЗГТ на липидный спектр крови, более выраженное в группе женщин, принимавших гормоны перорально (см. рисунок), коэффициент атерогенности значительно снизился у принимавших эстрогены перорально (на 23%) и на 14% у принимавших эстрогены парентерально. Выявлено различное воздействие используемых препаратов на уровень ТГ и ЛПОНП. Так, на фоне трансдермальной терапии имело место снижение концентрации ТГ и ЛПОНП соответственно на 11 и 8% (р<0,05), в то время как на фоне оральной терапии отмечено незначительное увеличение концентрации ТГ и ЛПОНП соответственно на 2,5 и 5% (р>0,05). В контрольной же группе наблюдали тенденцию к незначительному увеличению концентрации общего ХС, ХС ЛПВП, ХС ЛПНП, ТГ и ХС ЛПОНП и отношения ХС ЛПНП к ХС ЛПВП. Анализ воздействия исследуемых препаратов на апопротеиды выявил следующее: в обеих группах отмечено достоверное снижение концентрации апоВ (см. рисунок, г). Влияние на содержание апоА-1 оказалось различным: так, на фоне пероральной терапии отмечено увеличение концентрации апоА-1 на 11%, тогда как при трансдермальной терапии эстрогенами динамики практически не наблюдалось. В целом отношение апоВ к апоА-1 в обеих группах имело достоверную тенденцию к снижению, однако более выраженную при пероральной терапии (на 11 и 8%, соответственно), в то время как в контрольной группе имелась тенденция к повышению. Обсуждение Принято считать, что антиатерогенное воздействие ЗГТ на липидный спектр крови зависит от типа эстрогена, дозы и пути введения. Кроме того, для женщин с интактной маткой необходимо сочетание гестагенов с эстрогенами, что снижает риск возникновения гиперпластических процессов эндометрия. Но различные классы гестагенов по-разному воздействуют на липидный спектр крови, тем самым снижая эффективность эстрогенного компонента. Так, норэтистерона ацетат и левоноргестрел нивелируют положительное воздействие эстрогенов на ХС ЛПВП, в то время как дидрогестерон (С21 ретропрогестерон, лишенный андрогенной активности) не обладает таким свойством [5, 7, 13]. Таблица 2. Исходный липидный профиль у обследуемых женщин
Уровень ХС (а), ХС ЛПНП (б), ХС ЛПВП (в), апоВ (г) через 12 мес применения различных типов ЗГТ. Оральные эстрогены оказывают более выраженное влияние на липидный спектр крови, так как при первичном прохождении через печень кривая концентрации гормонов в 4—5 раз выше, чем при парентеральном пути введения [11]. А. Karjalainen и соавт. [11] при проведении рандомизированного двойного слепого плацебо контролируемого исследования у женщин в постменопаузе с удаленной маткой наблюдали через 6 мес от начала терапии эстрадиола валератом (2 мг/сут) снижение содержания общего ХС, ХС ЛПНП (на 8 и 19% соответственно) и увеличение концентрации ХС ЛПВП и ТГ (на 13 и 12% соответственно). При использовании конъюгированных эквин эстрогенов уровень ТГ повышался значительнее (на 20%) [4, 5], в то время как 17b-эстрадиол практически не повышал уровень ТГ [7, 13]. Следовательно, увеличение концентрации ТГ при пероральном использовании эстрогенов зависит от типа эстрогена. Согласно нашим данным, оральные и парентеральные эстрогены также снижают концентрацию ХС, ХС ЛПНП и повышают концентрацию ХС ЛПВП. Уровень ТГ при пероральной терапии 17b-эстрадиолом (клиогест) имел тенденцию к незначительному увеличению (динамика недостоверна), а при трансдермальной терапии достоверно снизился (на 11,5%). Механизм воздействия эстрогенов на липиды и липопротеиды до конца не изучен, но, очевидно, что увеличение активности рецепторов ЛПНП приводит к снижению концентрации ХС ЛПНП, в то время как повышение количества ТГ связано с увеличением образования как собственно ТГ, так и аполипротеида В. Анализ данных исследований парентеральной заместительной терапии эстрогенами также показал снижение (в среднем на 10—12%) уровня как атерогенных фракций липопротеидов (ХС, ХС ЛПНП), так и ТГ, в то же время уровень ХС ЛПВП или незначительно снижался или оставался на прежнем уровне. Так, в исследование E. Hirvonen и соавт. [9] обнаружено незначительное снижение уровня ТГ на фоне терапии гелем (1 мг) в сочетании с медроксипрогестерона ацетатом, концентрация же ХС ЛПВП осталась практически без изменений. Однако в исследовании A. Karjalainen и соавт. [11] не было обнаружено изменений уровня как ХС ЛПВП, так и ТГ. В нашем исследовании мы также не отмечали изменений концентрации ХС ЛПВП на фоне парентеральной терапии, хотя уровень общего ХС и ХС ЛПНП снизился, что в свою очередь привело к снижению коэффициента атерогенности, уровень же ТГ достоверно снизился. Одновременно со снижением концентрации ХС ЛПНП при обоих типах ЗГТ наблюдалось также снижение концентрации основного апопротеида этих липопротеидов (апоВ), более выраженное в группе женщин, принимавших клиогест перорально. Уровень же другого апопротеида (апоА-1), являющегося основным белком ЛПВП, согласуется с изменениями концентрации ХС ЛПВП. Так, на фоне парентеральной терапии изменений не наблюдали, тогда как при пероральном назначении ЗГТ концентрация апоА-1 существенно повысилась. Следовательно, наши данные согласуются с результатами проведенных ранее исследований [7, 8]. Уже известно о существовании взаимосвязи уровня гормонов и концентрации липидов в сыворотке крови у женщин в пре-, пост- и хирургической менопаузе. Поэтому, несмотря на то, что пероральные эстрогены оказывают более выраженное влияние на метаболизм липидов и липопротеидов в печени, их концентрации не являются решающими при снижении уровня ХС ЛПНП, о чем свидетельствует эффективность трансдермальных эстрогенов. Однако более важным представляется их влияние на метаболизм в печени по отношению к ХС ЛПВП, так как в нашем исследовании концентрация ХС ЛПВП не изменялась при использовании эстрадиола в виде накожного геля. Использование в качестве гестагенного компонента в пероральной группе норэтистерона ацетата (1 мг) и дюфастона (5 мг) в парентеральной группе не оказывало отрицательного воздействия на эффективность заместительной терапии эстрогенами. Хотя более существенное увеличение концентрации ТГ при пероральном приеме эстрогенов может быть также объяснено и влиянием норэтистерона ацетата, обладающего слабой андрогенной активностью. Поскольку пероральная терапия эстрогенами оказывает более выраженное действие на липиды и липопротеиды крови, то казалось бы логичным отдать предпочтение пероральным формам ЗГТ. Однако в практической деятельности при выборе того или иного вида терапии крайне важно учитывать особенности перорального и трансдермального пути введения эстрогенов. Так, оральный путь введения гормонов требует более высоких доз для достижения терапевтического эффекта, сопровождается пиками концентрации Е в крови. При первичном прохождении через печень происходит активный метаболизм, что сопровождается стимуляцией синтеза различных веществ — факторов свертывания, ангиотензиногена, половых стероидсвязывающих глобулинов, тироксинсвязывающего глобулина; из-за снижения синтеза желчных кислот появляется предрасположенность к образованию камней в желчном пузыре, также происходит увеличение синтеза ТГ. Поэтому в клинической практике все чаще находит применение трансдермальных гормонов, так как они могут оказаться эффективными в случаях нечувствительности к оральной терапии. Поскольку при трансдермальном пути введения нет первичного прохождения гормонов через печень, их можно назначать при заболеваниях печени, поджелудочной железы, мальабсорбции, при расстройствах коагуляции, высоком риске венозных тромбозов, гипертриглицеридемии до и на фоне оральной терапии, гипертензии, гиперинсулинемии, повышенном риске холелитиаза, курении, мигренях, с целью снижения инсулинорезистентности и улучшения толерантности к глюкозе. Выводы 1. Пероральная заместительная терапия эстрогенами (17b-эстрадиол 2 мг/сут) у женщин в постменопаузе в течение года терапии оказывает выраженное антиатерогенное воздействие на липидный спектр крови. 2. Трансдермальная терапия эстрогенами (дивигель 1 г/сут) в течение года у женщин в постменопаузе также оказывает благоприятное воздействие на липиды и липопротеиды крови. 3. Воздействие пероральной терапии на липидный спектр крови более выраженно, чем трансдермальное, что объясняется более высокой (в 4—5 раз) концентрацией гормона в печени при первичном метаболизме. 4. Прогестагены (норэтистерона ацетат и дидрогестерон) не ослабляют положительного действия 17b-эстрадиола на липиды и липопротеи ды крови. В.П. Сметник, А.А. Дьяконова Центр акушерства, гинекологии и перинатологии, Москва Литература 1. ACOG educational bulletin. Hormone Replacment therapy. Number 247, May 1998. Int J Gynaecol Obstet 1998; 62: 299—308. 2. Albey M., Owen A. et al. Effects of menopause and hormone replacement therapy on plasma lipids, lipoproteins and LDL-receptor activity. Maturitas 1999; 33: 259—269. 3. Alexandersen P., Byrjalsen I., Christiansen C. Piperazine oestrone sulphate and interrupted norethisterone in postmenopausal women: effects on bone mass, lipoprotein metabolism, climacteric symptoms, and advers effects. Br J Obstet Gynaecol 2000; 107: 356—364. 4. Birkhauser M., Haenggi W. Lipid changes induced by HRT administered by different routes. 1998. 5. Crooc D., Godsland I.F., Stevenson J.C. The cardiovascular risk profile of hormone replacement therapies containing dydrogesterone: a review. Eur Menopause J 1995; 2: 23—29. 6. Crook D. The metabolic consequences of treating postmenopausal women with non-oral hormone replacement therapy. Br J Obstet Gynaecol 1997; 104: 4—13. 7. Crook D., Godsland I.F., Hull J., Stevenson J.C. Hormone replacement therapy with dydrogesterone and 17b-oestradiol: effects on serum lipoproteins and glucose tolerance during 24 month follow up. Br J Obstet Gynaecol 1997; 104: 298—304. 8. Hanggi W., Lippuner K., Riesen W., Jaeger Ph., Birkhauser M.H. Long term influence of different postmenopausal hormone replasment tegimens on serum lipids and lipoprotein (a): a randomised study. Br J Obstet Gynaecol 1997; 104: 708—717. 9. Hirvonen E., Lamberg-Allardt C., Lankinen K.S. et al. Transdermal oestradiol gel in the treatment of the climacterium: a comparison with oral therapy. Br J Obstet Gynaecol 1997; 104: 19—25. 10. Jarvinen A., Granader M. et al. Effects of dose on the absorption of oestradiol from a transdermal gel. Maturitas 2000; 35: 51—56. 11. Karjalainen A., Heikkinen J., Savalainen M.J. et al. Metabolic changes induced by peroral oestrogen and transdermal oestradiol gel therapy. Br J Obstet Gynaecol 1997; 104: 38—43. 12. Mijatovic V., Van der Mooren M.J. et al. Postmenopausal hormone replacement, risk estimators for coronary artery disease and cardiovascular protection (review). Gynecol Endocronol 1999; 13: 130—144. 13. Маличенко С.Б., Лазебник Л.Б. Особенности клинического течения сердечно-сосудистых заболеваний у женщин с постменопаузальным остеопорозом. Возможности применения фемостона при терапии поздних заболеваний климактерия. Клиническая медицина 2000; 7: 50—56. 14. Windler E. Modification of serum lipids and cardiovascular risk by estrogenic active compounds. Gynecol Endocronol 1999; 13: Suppl 6: 21—28. |