Исследование контрацептивной активности нитазола методом спиновых зондов.
|
Механизмы активности фармакологических препаратов разнообразны и связаны с угнетением тех или иных звеньев жизнедеятельности микроорганизмов. Важную роль в механизмах антимикробного действия химических веществ играют связывание их с мембранами клеток и нарушение функционирования цитоплазматических мембран.
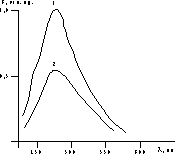
Известно, например, что хинозол (производное группы 2-минотиазола) находит широкое применение в медицине в качестве препарата, обладающего противовоспалительным, антимикробным и сперматоцидным свойствами. С точки зрения действия на клетки нитазола, соединения той же группы, можно прогнозировать его определенную контрацептивную активность, важным звеном которой может быть воздействие на состояние мембран сперматозоидов. В настоящее время оценка контрацептивной активности веществ in vitro проводится визуально под микроскопом с помощью подсчета количества подвижных сперматозоидов до и после воздействия контрацептива [4]. Однако этот метод не лишен субъективности, в связи с чем целью работы было изучение контрацептивной активности нитазола по степени деструкции клеток in vitro c использованием метода спиновых зондов [3]. Материал и методы Для исследования использовали 2,5% раствор нитазола в диметилформамиде и для сравнения — растворы применяющихся контрацептивных веществ: 0,1% раствор борной кислоты и 0,05% раствор хинозола. Во всех случаях для определения контрацептивной активности изучаемых веществ концентрацию сперматозоидов предварительно доводили фосфатно-солевым буфером (рН 7,2—7,4) до 40·10 в миллилитре. Затем к 1 мл спермы добавляли 0,1—0,4 мл изучаемых растворов, инкубировали смесь при комнатной температуре в течение 3 мин и образцы исследовали под микроскопом (Биолам-ґ400) и методом электронного парамагнитного резонанса (ЭПР). Суть данного способа заключается в том, что в исследуемую взвесь клеток вводится водорастворимый спиновый зонд в комбинации с парамагнитными ионами, причем молекулы зонда быстро проникают в цитоплазму, в то время как парамагнитные ионы не проникают через нативную мембрану. В результате регистрируется спектр ЭПР зондов, находящихся исключительно в цитоплазме, так как спектр ЭПР внеклеточных зондов не регистрируется (уширяется до нуля) вследствие взаимодействия молекул зонда и ионов никеля. При нарушении целостности мембран вследствие действия физико-химических факторов ионы парамагнитной соли начинают проникать в цитоплазму, что приводит к уменьшению интенсивности сигнала ЭПР внутриклеточных зондов в зависимости от количества поврежденных клеток. Таким образом, определение процента целых клеток основано на том, что интенсивность линий спектра ЭПР пропорциональна количеству неповрежденных клеток [3]. В работе были использованы водорастворимый стабильный нитроксильный радикал 2,2,6,6-тетраметил-4-оксо-пиперидин-1-оксил (ТЕМПОН) и хлористый никель в качестве уширяющего агента. Концентрации зонда и соли в суспензии клеток были соответственно 1 и 100 ммоль. Спектры ЭПР регистрировали на спектрометре "Bruker ER-100D" (Германия). Изучение сродства нитазола к липидам биомембран проводили на примере взаимодействия его с модельными мембранами из фосфатидилхолина. Липосомы получали ультразвуковой обработкой многослойных везикул из фосфатидилхолина на частоте 22 кГц в 0,1 М трис-буфере при рН 7,2 [1]. Концентрация лецитина во взвеси составляла 0,05%. Взаимодействие нитазола с модельными мембранами изучали методом флюоресцентных зондов по изменению интенсивности флюоресценции зонда 1-анилинонафталин-8-сульфонат (АНС) в мембранах липосом в присутствии ве ществ. Длина волны возбуждения флюоресценции АНС — 365 нм, максимум флюоресценции наблюдали при 475 нм [2]. Концентрация водного раствора нитазола в суспензии липосом составляла 5·10М. Спектры флюоресценции регистрировали на спектрофлюориметре "Hitachi MPF-2A" (Япония). Результаты и обсуждение При изучении подвижности сперматозоидов in vitro под микроскопом было установлено, что добавление возрастающих количеств растворов 0,05% хинозола, 2,5% нитазола приводит к уменьшению доли подвижных сперматозоидов в образце. После добавления в 1 мл эякулята 0,3—0,4 мл данных растворов сперматозоиды полностью обездвиживаются. Мембранотропное действие веществ можно оценить по изменению флюоресценции мембрановстроенного флюоресцентного зонда АНС вследствие вытеснения его из мембраны молекулами экзогенных агентов [2]. Дополнительное уменьшение интенсивности флюоресценции зонда может быть вызвано поглощением энергии молекулами применяющихся веществ. Обнаружено, что нитазол имеет поглощение в районе 365 нм [3]. Добавление нитазола к липосомам приводит к резкому уменьшению интенсивности флюоресценции АНС (рис. 1), происходит вытеснение его в раствор и образование нефлюоресцирующих конформеров [2]. Эти результаты cвидетельствуют о сродстве нитазола к липидам, что может играть определенную роль в механизмах его контрацептивного действия. Оценка контрацептивной активности препаратов методом ЭПР спиновых зондов предполагает установление корреляции между влиянием этих веществ на барьерную функцию мембран сперматозоидов и их подвижность. Из рис. 2 следует, что нативные мембраны при отсутствии добавок обладают барьерными свойствами в отношении внеклеточных ионов никеля (контроль). Характерные узкие линии спектра ЭПР зонда ТЕМПОН свидетельствуют о недоступности цитозольного зонда внеклеточным ионам, т.е. о целостности мембран всех сперматозоидов в пробе. Добавление 0,3 мл стандартного раствора хинозола вызывало полное уширение сигнала ЭПР ТЕМПОН, так как нарушалась барьерная функция мембран практически всех клеток через 10 мин. В присутствии 0,3 мл нитазола этот эффект развивался в течение 5 мин. Следовательно, взаимодействие нитазола и хинозола с липидами мембран сперматозоидов сопровождается нарушением их барьерных свойств и приводит к снижению оплодотворяющей способности гамет.
Рис. 1. Спектры флюоресценции 1,8-АНС в мембранах липосом. 1 — контроль; 2 — в присутствии нитазола.
Рис. 2. Спектры ЭПР спинового зонда в цитоплазме сперматозоидов. 1 — контроль; 2 — в присутствии хинозола через 10 мин; 3 — в присутствии нитазола через 2 мин; 4 — в присутствии нитазола через 5 мин. Таким образом, с помощью ЭПР спиновых и флюоресцентных зондов появилась возможность адекватно оценить целостность и степень деструкции сперматозоидов человека и установить контрацептивное действие нитазола. В частности, этот метод позволяет изучать динамику повреждения клеток, различать гаметы с частично и полностью поврежденными мембранами. Кроме того, регистрация по характерным изменениям вида спектра ЭПР ТЕМПОН соответствует распределению клеток по чувствительности к действию повреждающих агентов. В.И. Грищенко, М.И. Крамар, Л.В. Цымбал, Н.Н. Чуб, Л.В. Иванов Институт проблем криобиологии и криомедицины НАН Украины, Харьков, Украина Литература 1. Будкер В.Г., Вахрушева Т.Е., Киселева Е.В., Христолюбова Н.В. Получение липосом с лекарственными препаратами. М: Медицина 1987; 347—352. 2. Владимиров Ю.А., Добрецов Г.Е. Флюоресцентные зонды в исследовании биологических мембран. М: Наука 1980; 320. 3. Иванов Л.В., Моисеев В.А., Гаврилова И.И., Цымбал Л.В., Василовский В.Ю. А.с. № 1049808 (СССР), 1983, № 39. Способ определения степени деструкции клеток. 4. Кунин М.А. Бесплодие в браке. М: Медицина 1973; 9—14. |