Факторы роста и их роль в регуляции репродуктивной функции у больных
|
Углубленные исследования реакции клеток на гормональные воздействия позволили выявить сложную систему местных специфических факторов, осуществляющих контроль роста и дифференциации различных видов клеток путем изменения их протеолитической активности. Среди факторов межклеточного взаимодействия важную роль играют ростовые факторы.
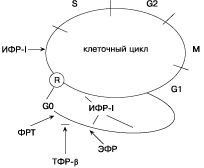
Факторы роста (ФР) — биологически активные соединения, стимулирующие или ингибирующие деление и дифференцировку различных клеток и являющиеся основными переносчиками митогенного сигнала клетки. В отличие от гормонов ФР, как правило, продуцируются неспецифическими клетками, находящимися во многих тканях. Система ФР включает: 1) полипептидные ростовые факторы; 2) специфические клеточные рецепторы; 3) связывающие белки, регулирующие количество ФР, действующие на клетки-мишени. ФР могут оказывать действие различными путями: 1) аутокринным — путем воздействия на клетки, являющиеся непосредственным источником ФР; 2) паракринным — путем воздействия на клетки, расположенные вблизи клеток продуцентов; 3) интракринным — ФР остаются внутри клетки и действуют непосредственно как внутриклеточные мессенджеры; 4) эндокринным — воздействие на удаленные клетки-мишени. Наиболее изученные ФР: инсулиноподобные факторы роста (ИФР), эпидермальный фактор роста (ЭФР), сосудистый эндотелиальный фактор роста (СЭФР), фактор роста тромбоцитов (ФРТ), трансформирующие факторы роста (ТФР-a, ТФР-b), колониестимулирующий фактор роста, фактор роста фибробластов (ФРФ), фактор некроза опухолей-a (ФНО-a), а также интерферон-2, интерлейкин-1, эндотелин-1. Все они относятся к факторам, стимулирующим рост клеток, за исключением интерферона-2, который является ингибитором роста, а ТФР-b, ФНО-a выступают и как стимуляторы, и как ингибиторы роста. ФР оказывают свое действие на различные фазы клеточного цикла. Известно, что клеточный цикл активно делящихся клеток состоит из четырех фаз [13] (схема 1). Синтез ДНК происходит во время ограниченного периода интерфазы (S-фазы). G1 — интервал между окончанием митоза и началом S-фазы. G2 — интервал между окончанием S-фазы и началом деления клетки, а М-фаза — период митоза и цитокинеза. Неделящиеся клетки находятся в состоянии покоя (G0-фазе).
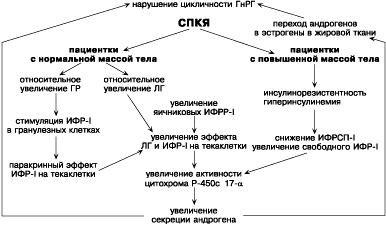
Клеточный цикл имеет две важнейшие точки регуляции, на которые оказывают воздействие ФР; эти точки различаются во времени и реагируют на разные митогены. Этими точками являются 1) ограничительная точка, в которой клетка нацеливается (становится обязанной) вступить в S-фазу; эта точка примерно на 2 ч предшествует началу синтеза ДНК; 2) присутствующая у неделящихся (с остановившимся ростом) клеток точка, расположенная в начале перехода от G0-фазы к G1-фазе [67]. ФРТ — фактор «дееспособности», который стимулирует переход неделящихся клеток из фазы G0 в фазу G1 и их становление, таким образом, способными к делению. ИФР-I — фактор «прогрессии», присутствие которого необходимо в G1-фазе, а также для вступления в S-фазу. ЭФР занимает промежуточное положение: он необходим в интервале между 2 и 6 ч после стимуляции ФР тромбоцитов выхода клетки из фазы G0. В отличие от этого ингибитор роста ТФР-b блокирует переход из фазы G0 в фазу G1. Остановимся на некоторых из наиболее изученных ФР, их экспрессии в яичниках и эндометрии при нормально функционирующих яичниках и при различных патологических состояниях. ИФР, или соматомедины, представляют собой группу гормонов роста, которые структурно похожи на инсулин и имеют широкие митогенные и метаболические эффекты [36]. Они обозначены как ИФР-I и ИФР-II из-за их крайней гомологии по структуре с инсулином. Сами по себе пептиды гомологичны инсулину на 62%. Рецептор инсулина имеет 1355 или 1367 аминокислот. Выясненная последовательность для ИФР-I соответствует белку с 1337 аминокислотами. Однако ген для инсулинового рецептора локализуется в хромосоме 19, в то время как ген для рецептора ИФР-I идентифицирован на дистальном участке длинного плеча хромосомы 15. Таким образом, два рецептора (рецепторы ИФР-I и инсулина) являются продуктом различных генов и соответственно регулируются различными регуляторными системами. Недавно была клонирована последовательность нуклеотидов для рецептора ИФР-II. Рецептор второго типа идентичен рецептору манноза-6-фосфат, который, по общему убеждению, вовлечен во внутриклеточный транспорт лизосомальных ферментов [64]. В дополнение к связыванию их рецепторов на клеточной мембране ИФР также с высокой активностью связываются с семейством структурно похожих циркулирующих ИФР-связывающих протеинов (ИФРСП) [2]. Хотя первично они были найдены в сыворотке [3], в настоящее время эти белки обнаружены в большом спектре биологических жидкостей, включая амниотическую, цереброспинальную, семенную, фолликулярную [57,61], также, как и в различных культуральных клеточных линиях [66]. Эти циркулирующие белки пролонгируют период полураспада ИФР и, таким образом, регулируют эндокринные эффекты этих факторов. Печень является главным источником циркулирующих ИФР [5]. У женщин с нормальным менструальным циклом циркулирующий уровень ИФР-I и ИФР-II не имеет различий в фолликулярную и лютеиновую фазы цикла [56]. Концентрация обоих в сыворотке также не изменяется при стимуляции овуляции человеческим менопаузальным гонадотропином [50,70]. Концентрация ИФР-II (но не ИФР-I) при исследовании была значительно выше в яичниковой вене, что также свидетельствует о яичниковом источнике этого пептида [56]. Доминантный фолликул содержит ИФР-I в большей концентрации, чем недоминантные когорты [39,40]. Более того, уровень ИФР-I в фолликулярной жидкости положительно коррелирует как с концентрацией эстрадиола, прогестерона, так и с объемом фолликулярной жидкости [39,40,74]. В исследованиях [41] методом in situ гибридизации транскрипты ИФР-I были обнаружены в теке малых (3—5 мм) развивающихся фолликулов и атретических фолликулах, но не найдены в гранулезных клетках. Однако ИФР-II мРНК наиболее часто встречались в гранулезных клетках больших развивающихся фолликулов и в желтом теле. Низкий уровень ИФР-II мРНК и связывающего протеина ИФР-II был обнаружен в текаклетках женщин с синдромом поликистозных яичников (СПКЯ), также как и в малых антральных фолликулах у нормально функционирующих женщин. Кроме того, обильная экспрессия ИФР-II мРНК и связывающего белка встречается в гранулезных клетках доминантного фолликула. Это привело к гипотезе «переключения» генной экспрессии ИФР-II из текаклеток на гранулезные клетки с созреванием малых антральных фолликулов в доминантные, которые представляют отличительный признак человеческого фолликулогенеза. Более того, отсутствие подобного перемещения в фолликулах при СПКЯ может объяснять «арест» фолликула, имеющийся в этих условиях. Более подробно остановимся на СПКЯ и ИФР. Известно, что СПКЯ — мультифакторная патология, для которой характерны олиго/аменоррея, хроническая ановуляция, гиперандрогения и, как следствие, гирсутизм и бесплодие [31]. Патогенез СПКЯ остается не до конца ясным, несмотря на большое количество исследований в этой области. Ведущей является центральная теория патогенеза, согласно которой данное патологическое состояние объясняется нарушениями образования нейротрансмиттеров в гипоталамической области, изменением цирхорального ритма выделения гонадотропин-рилизинг-гормона (ГнРГ) и, как следствие, количественными изменениями секреции гонадотропных гормонов: лютеинизирующего (ЛГ) и фолликулостимулирующего (ФСГ) [1,4,66,79,81,84]. Причины возникновения такого состояния остаются невыясненными; возможно, это связано с генетически детерминированным нарушением ритма и количества выделения ГнРГ. Хотя патофизиология СПКЯ недостаточно ясна, в яичниках при данном патологическом состоянии не происходит селекции доминантного фолликула, а имеются множество малых (меньше10 мм) фолликулов. Инсулинорезистентность и как следствие гиперинсулинемия вовлекаются в патогенез этого синдрома [11,24]. Роль инсулина в СПКЯ базируется на следующих заключениях: а) рецепторы для инсулина и структурно связанных ИФР-I были идентифицированы в тканях человеческого яичника [72]; б) инсулин стимулирует продукцию андрогена текаклетками и стромой культивированных клеток у женщин с гиперандрогенией и нормальных женщин [10]; в) инсулин усиливает ответ текаклеток и стромы на гонадотропины [42]; г) при некоторых синдромах вторичной резистентности инсулина, в основе которых лежит мутация гена инсулинового рецептора, встречается гиперандрогения [6,63]; д) кратковременное подавление уровня сывороточного инсулина уменьшает уровень сывороточного андрогена у некоторых пациенток с СПКЯ [65]. Инсулинорезистентность часто встречается и у тучных пациенток и у женщин с нормальной массой и не зависит от массы тела [22,37]. P. Richard и соавт. [78] исследовали реакцию инсулина при определении глюкозотолерантного теста per os и внутривенно у женщин с СПКЯ и без данной патологии. При сравнении с контролем у женщин с СПКЯ уровень инсулина был увеличен на 44 и 53% соответственно [22]. Более того, эти различия были относительно не связаны с индексом массы тела. Чувствительность ИФР-I при СПКЯ не нарушена, несмотря на снижение чувствительности к инсулину [21]. Предполагается, что при инсулинорезистентных состояниях повышение уровня связывания инсулина рецепторами ИПФР-I осуществляется через феномен избытка и как результат — стимуляция теки и увеличение выработки андрогенов [12]. Эта гипотеза подтверждается структурной гомологичностью рецепторов инсулина и ИФР-I. V. Insler [52] представляет возможные патофизиологические механизмы развития СПКЯ у пациенток с повышенной и нормальной массой тела (схема 2). В первом случае имеется резистентность к инсулину и, как следствие, гиперинсулинемия, которая, с одной стороны, увеличивает количество рецепторов ИФР-I в яичниках и, с другой — приводит к снижению уровня ИФРСП-I, что увеличивает количество несвязанного ИФР-I. Увеличение количества рецепторов ИФР-I в свою очередь приводит к усилению действия ЛГ и ИФР-I на текаклетки, следствием этого является повышение выработки андрогенов. У пациенток с СПКЯ с нормальной массой тела относительное увеличение количества гормона роста стимулирует ИФР-I в гранулезных клетках, что в свою очередь паракринным путем осуществляет эффект ИФР-I на текаклетки. Это, а также относительное увеличение содержания ЛГ способствует увеличению эффекта ЛГ и ИФР-I на текаклетки. Все это приводит к увеличению секреции андрогена. Андрогены переходят в эстрогены, а это ведет к нарушению цикличности ГнРГ, что является причиной СПКЯ. Таким образом, возникает замкнутый круг.
Система ИФР тесно связана с нарушением развития фолликула при СПКЯ. В фолликулярной жидкости нестимулированных яичников у женщин с СПКЯ наблюдается достоверно большое содержание ИФР-I по сравнению с группой контроля. Кроме того, концентрация общего и свободного ИФР-I в сыворотке женщин с СПКЯ увеличена в сравнении сывороткой здоровых женщин [54]. Было предположено, что повышенный уровень ЛГ, часто наблюдаемый при данной патологии, может увеличивать продукцию ИФР-I текаклетками в поликистозных яичниках и продукцию андрогена [15,45]. В экспериментах с гранулезными клетками поликистозных яичников in vitro показано, что физиологическая концентрация ИФР-I по эффективности стимуляции продукции эстрадиола не уступает ФСГ [42]. Таким образом, ИПФР-I и ФСГ действуют как синергисты на увеличение продукции эстрадиола [42]. Итак, ИФР-I и ИФР-II интимно связаны с развитием фолликулов, стероидогенезом и функцией желтого тела. Эта сложная система каскадных эффектов включает гонадотропины, ФР, инсулин и семейство связывающих белков ИФР. Более глубокое изучение системы ИФР будет способствовать открытию новых перспектив в лечении таких патологических состояний, как ановуляция и гиперандрогения, а также подборе адекватного лечения бесплодных пар. СЭФР — связывающий гепарин димерный полипептидный ФР, первоначально выделенный в чистом виде на основании его свойства усиливать проницаемость сосудов; позднее было показано, что СЭФР является мощным митогеном для эндотелиальных клеток [32,43, 85] и изменяет экспрессию нескольких протеолитических ферментов, участвующих в ангиогенезе [71, 93]. Были идентифицированы четыре вида молекул СЭФР (СЭФР 121, СЭФР 165, СЭФР 189, СЭФР 206), которые образуются за счет альтернативного мРНК-сплайсинга одного гена [92]. Пятый сплайсинговый вариант — СЭФР 145 — был выявлен в эндометрии недавно [25]. Оба известных рецептора СЭФР, присутствующих в организме человека — flt и KDR [90, 95] — являются тирозинкиназами клеточной поверхности и экспрессированы преимущественно на эндотелиальных клетках [32,43,55]. Интерес к СЭФР за последнее время особенно возрос в связи с повышенным интересом к проблеме ангиогенеза эндометриоза и патогенеза опухолевых образований яичников, а также более детальным изучением функции клеток гранулезы. Установлено, что генитальный эндометриоз — заболевание, сопровождающееся дисменореей, болевым синдромом и бесплодием, обнаруживается более чем у 50% женщин, страдающих бесплодием [7]. Ангиогенез, вероятно, играет роль в патогенезе эндометриоза, поскольку для успешной имплантации и роста эндометриальной ткани требуется новообразование сосудов. Имплантанты эндометрия имеют склонность сопровождаться повышенным кровоснабжением, а экстрагенитальный эндометриоз обнаруживается в местах, имеющих хорошую васкуляризацию, например, в легких, коже и мышцах [76]. Перитонеальная жидкость, полученная у женщин, страдающих эндометриозом, имеет повышенную ангиогенную активность по сравнению с перитонеальной жидкостью, полученной у женщин, не имеющих данного заболевания [69,83]. Уровень ангиогенной активности эндометрия, возможно, является одной из детерминант, определяющих вероятность имплантации и прогрессирования эндометриоза. Лучшее понимание факторов, регулирующих васкуляризацию эндометрия, позволит более эффективно лечить многие патологические состояния, включая эндометриоз, дисфункциональные маточные кровотечения и рак эндометрия. При метастазах рака яичника происходит обильная выработка асцитической жидкости. Это навело на мысль о возможном участии СЭФР в патогенезе раковых опухолей яичников. Экспрессия СЭФР присутствует в здоровых яичниках приматов и человека [68,77]; его экспрессия повышается во многих опухолях человека (включая рак яичника) по сравнению с нормальными тканями [16,17,20,44,85]. В исследованиях с использованием реакции полимеразной цепочки выявили присутствие транскриптов, кодирующих flt и KDR в клеточных линиях рака яичника, которые также имели экспрессию мРНК СЭФР. Этот неожиданный результат позволил предположить, что СЭФР может действовать не только как ангиогенный фактор, но и более основательно — как аутокринный или паракринный регулятор роста, действующий через рецепторы, экспрессируемые опухолевыми клетками [28]. Помимо стимуляции митогенной активности, СЭФР оказывает еще несколько воздействий на эндотелиальные клетки, в том числе стимулирует синтез и высвобождение протеаз и фактора Виллебранда — посредника адгезии тромбоцитов, участвующего в коагуляции белков плазмы, высвобождающихся из кровеносных сосудов, имеющих повышенную проницаемость [19,71,93]. В процессе ангиогенеза опухолей яичников играет роль стимуляция новообразования эндотелиальных клеток, их подвижности и высвобождения ими протеаз, усиливающих проницаемость базальных мембран и внеклеточного матрикса. Ускоренное новообразование клеток и прорастание ими тканей характерны и для инвазивных опухолей; данные свойства, вероятно, обусловлены присутствием в опухолях экспрессирующих рецептор клеток в сочетании с локальным возрастанием экспрессии СЭФР. В связи с этим СЭФР и его рецепторы являются потенциально важными мишенями лечебных воздействий, направленных против рака яичника. Недавно СЭФР, а также лептин — белок, участвующий в различных видах регулярной деятельности, включая гемопоэз [14,29], отложение жира и жировой обмен [33,97], а также репродукцию [26,27,30], присутствующие в относительно высоких концентрациях в фолликулярной жидкости человека, были идентифицированы как секреторные продукты клеток гранулезы и яйценосного бугорка (cumulus oophorus). M. Antczak и соавт. [8] описывают субпопуляции клеток гранулезы и cumulus oophorus, демонстрирующие выраженную активность и необычную морфодинамику поведения, связанную с накоплением СЭФР, лептина и ТФР-b2. Эти клетки образуют множественные баллонообразные структуры, соединяющиеся с их апикальными поверхностями посредством тонкого стебелька, образованного плазматической мембраной. Этот необычный апокриноподобный механизм наблюдался в свежевыделенных массах человеческого кумулюса и клетках гранулезы; данный феномен сохранялся и в культуре. Авторами выдвинуто предположение о том, что формирование присоединенной структуры представляет собой новый механизм накопления и секвестрации ФР, имеющий место в пре- и постовуляторных фолликулах человека; можно предположить, что данный механизм поддерживает уникальный порядок направленной секреции, который, возможно, играет роль в обеспечении быстрых подъемов клеточного роста и дифференцировки во время роста фолликула и формирования желтого тела. ЭФР — полипептид, состоящий из одной цепи в 53 аминокислоты с тремя дисульфидными мостиками, которые защищают его молекулу от действия протеинкиназ. ЭФР — потенциальный митоген, стимулирующий пролиферацию многих типов клеток, включая фибробласты, кератиноциты и эпителиальные клетки [23]. Иммунореактивным методом выявлено, что ЭФР локализуется в стромальных клетках эндометрия в течение пролиферативной фазы, уровень его увеличивается в секреторную фазу. В секреторную фазу цикла обнаруживается на поверхности эпителия и вокруг спиральных артериол, во время беременности в децидуальном эпителии и в синцитиотрофобласте [49,51]. По данным других авторов, содержание ЭФР не изменяется в эндометрии на протяжении менструального цикла. ЭФР и родственный ему ТФР-a имеют общий рецептор, который кодируется геном c-erb [35]. Рецептор ЭФР (РЭФР) представляет собой одновременно и тирозинкиназу, которая активируется при взаимодействии рецептора с лигандом. Рецепторная тирозинкиназа физически связана с фосфотирозинфосфатазой, эти два фермента не просто оказывают противоположное действие (тирозинкиназа фосфорилирует белки по тирозину, а фосфатаза дефосфорилирует), их согласованная активность обеспечивает тонкий баланс в передаче эффекторных сигналов, необходимых для клеточного роста и дифференцировки [94]. Результатом фосфорилирования/дефосфорилирования ключевых клеток могут быть их активация/инактивация, открытие ионных каналов, экспрессия генов. Многие эффекты рецепторных тирозинкиназ опосредуются активацией проонкогена ras [59]. РЭФР также активирует проонкогены c-fos и c-myc [58]. Во многих опухолях установлены сверхэкспрессия РЭФР или мутации в генах, кодирующих его, вероятно, ответственные за опухолевую трансформацию [35,46]. При раке предстательной железы отмечается увеличение содержания мРНК РЭФР, но уменьшение содержания самого белка при определении иммунохимическим методом. Повышенное содержание РЭФР было выявлено в опухолях яичника, матки, молочных желез, желудочно-кишечного тракта и при раке кожи. Наиболее изучено клиническое значение РЭФР при раке молочной железы. ЭФР стимулирует рост раковых клеток молочной железы и этим дополняет эстрогенстимулированный опухолевый рост. Установлено, что РЭФР опосредуют воздействие ЭФР и ТФР-a и являются прогностическими маркерами для опухолей молочной железы. В серии исследований было установлено, что высокое содержание РЭФР часто коррелирует с низким уровнем эстрогенных и прогестероновых рецепторов и сочетается с меньшей выживаемостью больных по сравнению с больными, имеющими РЭФР-отрицательные опухоли. Экспрессия РЭФР на клетках рака молочной железы является показателем не только неблагоприятного прогноза, но и низкой чувствительности к гормонотерапии, в частности к тамоксифену. ФРТ является митогеном для мезенхимальных клеток, но в некоторых исследованиях показано, что и эпителиальные и эндотелиальные клетки также могут отвечать на данный фактор роста [75,87,88]. ФРТ — димерный протеин, состоящий из связанных А и В полипептидных цепей, кодирующихся различными генами. Все три изоформы (АА, АВ, ВВ) изолированы от источника и связываются двумя различными рецепторами. РФРТ-a связывает все три изоформы высокой и равной аффинитивностью, тогда как РФРТ-b связывает только ФРТ-ВВ с высокой аффинитивностью, а ФРТ-АВ — с низкой. Выявлено что, ФРТ и РФРТ-a обнаружены в раковых и пограничных опухолях яичников, но не найдены в нормальном яичниковом эпителии. Кроме того, экспрессия РФРТ-a в опухолевых клетках значительно коррелирует со снижением продолжительности жизни, а РФРТ-b не обнаружен в эпителиальных опухолевых клетках [48]. Структурным аналогом ЭФР, на 30% гомологичным по первичной структуре, взаимодействующим с РЭФР и конкурирующим за него, проявляющим сильное митогенное действие, является ТФР-a. Доказательством выраженных митогенных свойств является факт обнаружения ЭФР в половине образцов биоптатов рака эндометрия, а ТФР-a — почти во всех образцах. ТФР-a принимает участие в росте и стимуляции дифференциации фолликулов и пролиферации клеток гранулезы. Полагают, что ТФР-a является одним из аутокринных ФР рака яичника. ТФР-a выявлен в резервных и метапластических поверхностных клетках переходной зоны шейки матки. Увеличение экспрессии этого фактора отмечается при инвазивном раке шейки матки. Результаты некоторых исследований позволяют предполагать, что индукторами экспрессии ТФР-a в эпителиальных клетках шейки матки может являться папилломавирусная инфекция. Механизмы гормонального контроля ТФР-a, как и ЭФР, точно не установлены, определенную роль в индукции синтеза ТФР-a играют андрогены и инсулин. Семейство ТФР-b в настоящее время представлено фактором b1 (впервые обнаружен в тромбоцитах), фактором b2 (выявлен в тромбоцитах, костной ткани и в некоторых клеточных линиях) и фактором b3 (обнаружен во многих клеточных линиях преимущественно мезенхимального происхождения). ТФР-b — мультифункциональный пептид, который стимулирует так же хорошо, как и ингибирует клеточную пролиферацию и дифферециацию [89]. Экспрессия ТФР-b1 возрастает при многих опухолях [35], в том числе при раке предстательной железы. В экспериментах с опухолевой трансформацией онкогенами ras и myc показана роль ТФР- b1 и ТФР-b2 в процессе перехода доброкачественной гиперплазии в злокачественную [91]. В 1994 г. R. Henriksen [47] показал, что: а) экспрессия ТФР-b повышена в злокачественных опухолях яичников и сравнима с экспрессией в пограничных образованиях и в нормальных эпителиальных клетках; б) экспрессия ТФР- b3 указывает на позитивную корреляцию с продолжительностью жизни; в) экспрессия ТФР- b1, ТФР-b рецептор типа 1 или эндоглина в кровеносных сосудах прямо пропорциональна продолжительности жизни, что свидетельствует об антиангиогенной активности ТФР-b в опухолях яичников. Данные выводы позволят понять патогенез многих опухолей яичников, прогнозировать течение заболевания и осуществлять подбор новых методов лечения. ФРФ — представитель семейства гепаринсвязывающих факторов роста (ГСФР), которое включает в себя продукты генов ГСФР-1 (кислый ФРФ, или a-ФРФ), ГСФР-2 (основной ФРФ, или b-ФРФ), гена int-2, гена hst (ФРФ саркомы Капоши), а также ФРФ-5, ФРФ-6 и фактор роста кератиноцитов. Иммуногистохимически выявлено, что ФРФ локализуется на базальных мембранах средних кровеносных сосудов и на гладкомышечных клетках, на эндотелиальных клетках капилляров и базальной мембране многих тканей, включая эндометрий [34]. Основной ФРФ был найден в экстрактах клеточных линий эндометриальной аденокарциномы, где их секреция регулировалась стероидными гормонами [73]. В частности, секреция основного ФРФ увеличивалась в ответ на 17b-Е2 и ингибировалась пролактином [73]. Эти исследования приводят к тому, что основной ФРФ может быть включен в неоваскуляризацию эндометриальных аденокарцином также хорошо, как и в неоваскуляризацию нормального эндометрия на протяжении всего менструального цикла. В эндометрии нормально функционирующих женщин ФРФ представлен в высокой концентрации, которая не меняется на протяжении всего менструального цикла и увеличивается в атрофичном эндометрии [82]. Эти выводы достаточно странные, если учесть обширную неоваскуляризацию в эндометрии нормально менструирующих женщин и минимальную — атрофичного, постменопаузального. Таким образом, ФРФ находится в эндометриальных железах эпителия [34] и является митогеном в культивированных энометриальных стромальных клетках [53]. Эти исследования вовсе не исключают ФРФ из ангиогенных факторов в эндометрии, хотя в этом процессе могут играть роль другие ФР. ФРФ может быть одним из некоторых ФР, действующих паракринно между железистым эпителием и стромой, и вносит свой вклад в пролиферацию стромы. Таким образом, дисбаланс ФР, образующих сложную систему локальных регуляторов клеточного роста и дифференцировки, их гипо- и гиперпродукция могут провоцировать развитие патологических процессов в различных звеньях репродуктивной системы. Дальнейшее изучение межклеточных взаимодействий в норме и при патологии позволит представить новые перспективы для совершенствования патогенетической терапии патологических состояний, в основе которых лежит активация пролиферативных процессов. В.А. Бурлев, А.С. Гаспаров, Н.С. Аванесян, Н.И. Волков, Д.А. Стыгар РНИЦ акушерства, гинекологии и перинатологии РАМН, Москва Литература 1. Алиева Э.А. Синдром поликистозных яичников у женщин репродуктивного возраста: Дисс. ... докт. мед. наук. М 1991;366. 2. Балаболкин М.И. Эндокринология. М Медицина. 1989. 3. Бенедиктов Д.И. Лечение и реабилитация больных синдромом склерокистозных яичников: Дисс. ... канд. мед. наук. Свердловск, 1981;189. 4. Ефремова Л.Д. Применение препарата дифенин с целью восстановления репродуктивной функции у пациенток с синдромом поликистозных яичников: Дисс. ... канд. мед. наук. М 1993;130. 5. Жмакин К.Н. Гинекологическая эндокринология. М Медицина.1980;75—77. 6. Accili D., Frapier C., Mosthaf L. et al. A mutation in the insulin receptor gene that impairs transport of the receptor to the plasma membrane and causes insulin-resistance diabetes. EMBO J 1989;8:2509—17. 7. American Fertility Society. Classification of endometriosis. Fertil Steril 1979;32:5—6:633—634. 8. Antczak M., Van Blerkom J., Clark A. A novel mechanism of vascular endothelial growth factor, leptin and transforming growth factor-beta 2 sequestration in a subpopulation of human ovarian follicle cells. Hum Reprod 1997;10:2226—2234. 9. Artini P.G., Battaglia C., D’ Ambrogio G., Barreca A. et al. Relationship between human oocyte maturity, fertilization and follicular fluid growth factors. Hum Reprod 1994;9:902—906. 10. Barbieri R.L., Makris A., Randall R.W. et al. Insulin stimulates androgen accumulation in incubations of ovarian stroma obtained from women with hyperandrogenism. J Clin Endocrinol Metab 1986;62:904—9. 11. Barbieri R.L., Ryan K.J. Hyperandrogenism, insulin resistance, and acanthosis nigricans syndrome: a common endocrinopathy with distinct pathophysiologic features. Am J Obstet Gynecol 1983;147:90—101. 12 Barbieri R.L., Smith S., Ryan K.J. The role of hyperinsulinemia in the pathogenesis of ovarian hyperandrogenism. Fertil Steril 1988;50:197—212. 13. Baserga R. The biology of cell reproduction. Cambridge (MA): Harvard University Press 1985:46—58. 14. Bennett B., Solar G., Yuan J. et al. A role for leptin and its cognate receptor in haematopoiesis. Curr Biol 1996;6:1170—1180. 15. Bergh C., Carlsson B., Olsson J.H., Sellskog U., Hillensjo T. Regulation of androgen production in cultured human thecal cells by insulin-like growth factor-I and insulin. Fertil Steril 1993;52:323—31. 16. Berkman R.A., Merrill M.J., Reinhold W.C. et al. Expression of the vascular permeability factor/vascular endothelial growth factor gene in central nervous system neoplasms. J Clin Invest 1993;91:153—159. 17. Berse B., Brown L.F., Van De Water L. et al: Vascular permeability factor (vascular endothelial growth factor) gene is expressed differentially in normal tissues, macrophages, and tumors. Mol Biol Cell 1992;3:211—220. 18. Brannstrom M., Norman R., Seamark R., Robertson S. Rat ovary produces cytokines during ovulation. Biol Reprod 1994;50: 88—94. 19. Brock T.A., Dvorak H.F., Senger D.R. Tumor-secreted permeability factor increased scytosolic Ca 2+ and von Willebrand factor release in human endothelial cells. Am J Pathol 1991;38:213—221. 20. Brown L.F., Berse B., Jackman R.W. et al. Increased expression of vascular permeability factor (vascular endothelial growth factor) and its receptors in kidney and bladder carcinomas. Am J Pathol 1993;143:1255—1262. 21. Buyalos R.P., Geffner M.E., Bersch N. et al. Insulin and insulin-like growth factor-I responsiveness in polycystic ovarian syndrome. Fertil Steril 1992;57:796—803. 22. Buyalos R.P., Geffner M.E., Watanabe R.M. et al. The influence of luteinizing hormone and insulin on sex steroids and sex hormone-binding globulin in the polycystic ovarian syndrome. Fertil Steril 1993;60:626—33. 23. Carpenter G., Cohen S. Epidermal growth factor. Annu Rev Biochem 1979;48:193—216. 24. Chang R.J., Nakamura R.M., Judd H.L. et al. Insulin resistance in nonobese patients with polycystic ovarian disease. J Clin Endocrinol Metab 1983;57:356—9. 25. Charnock-Jones D., Sharkey A., Rajput-Williams J. et al. Identification and localization of alternately spliced mRNAs for vascular endothelial growth factor in human uterus and estrogen regulation in endometrial carcinoma cell lines. Biol Reprod 1993;48:1120—1128. 26. Chehab F., Lim M., Lu R. Correction of the cterility defect in homozygous obese female mice by treatment with the human recombinant leptin. Nature Genet 1996;12:318—320. 27. Chehab F., Mounzih K., Ronghua L., Lim M. Early onset of reprodactive function in normal female mice treated with leptin. Science 1997;275:88—90. 28. Christine A., Boocock D. et al. Expression of vascular endothelial growth factor and its receptors flt and KDR in ovarian carcinoma. J Nat Cancer Institute 1995;87:7:506—516. 29. Cioffi J., Shafer A., Zupancic T. et al. Novel B219/OB receptor isoforms: possible role of leptin in hematopoiesis and reprodaction. Nature Med 1996;2:585—589. 30. Cioffi J., Van Blerkom J., Antczak M. et al. The expression of leptin and its receptors in preovulatory human follicles. Mol Hum Reprod 1997;3:467—472. 31. Coldzieher J.W., Green J.A. The polycystic ovary. I. Clinical and histologic features. J Clin Endocrinol Metab 1962;22:325—38. 32. Connolly D.T., Heuvelman D.M., Nelson R. et al. Tumor vascular permeability factor stimulates endothelial cell growth and angiogenesis. J Clin Invest 1989;84:1470—1478. 33. Considine R., Sinha M., Heiman M., Kriauciunas A. et al. Serum immunoreactive-leptin concentrations in normal-weight and obese humans. New Engl Med 1996;334:292—296. 34. Cordon-Cordo C., Vlodavsky I., Haimovitz-Friedman A., Hicklin D., Fuks Z. Expression of basic fibroblast growth factor in normal human tissues. Lab Invest 1990;63:832—40. 35. Daughaday W.H., Deuel T.F. Endocrinol. Metab Clin N Amer 1991;20:3:539—563. 36. Daughaday W.H., Rotwein P. Insulin-like growth factors I and II. Peptide, messenger ribonucleic acid and gene structures, serum and tissue concentrations. Endocr Rev 1989;10:1:68—91. 37. Dunaif A., Segal K., Futterweit W., Dobrjansky A. Profound peripheral insulin-resistance, independent of obesity, in polycystic ovary syndrome. Diabetes 1989;38:1165—74. 38. Echternkamp S., Spicer L., Gregory K. et al. Concentrations of insulin-like growth factor-I in blood and ovarian follicular fluid of cattle selected for twins. Biol Reprod 1990;43:8—14. 39. Eden J.A., Jones J., Carter G.D. et al. A comparison of follicular fluid levels of insulin-like growth factor I in normal dominant and cohort follicles, polycystic and multicystic ovaries. Clin Endocrinol 1988;29:327—36. 40. Eden J.A., Jones J., Carter G.D. et al. Follicular fluid concentrations of insulin-like growth factor I, epidermal growth factor, transforming growth factor-alpha and sexsteroid in volume matches normal and polycystic human follicles. Clin Endocrinol 1990;32:395—405. 41. El-Roeiy A., Chen X., Roberts V.J. Expression of the genes encoding the insulin-like growth factors (IGF-I and II), the IGF and insulin receptors, and IGF-binding proteins 1—6 and the localization of the gene products in normal and polycystic ovary syndrome ovaries. J Clin Endocrinol Metab 1994;78:1488—96. 42. Erickson G.H., Magoffin D.A., Cragun J.R., Chang R.J. The effects of insulin and insulin-like growth factors-I and -II on estradiol production by granulosa cells of polycystic ovaries. J Clin Endocrinol Metab 1990;70:894—902. 43. Ferrera N., Henzel W.J. Pituitary follicular cells secrete a novel heparin-binding growth factor specific for vascular endothelial cells. Biochem Biophys Res Commun 1989;161:851—858. 44. Gitay-Goren H., Halaban R., Neufeld G. Human melanoma cells but not normal melanocytes express vascular endothelial growth factor receptors. Biochem Biophys Res Commun 1993;190:702—708. 45. Giudice L.C. Insulin-like growth factors and ovarian follicular development. Endocr Rev 1992;13:641—69. 46. Hayman M.J., Enrietto P.J. Cancer cells. 1991;3:8:302—307. 47. Henriksen R. Ovarian carcinogenesis. A study of markers for growth requlatory mechanisms in epithelial ovarian tumors. Acta universitatis Upsaliensis. Uppsala 1994. 48. Henriksen R., Funa K., Wilander E. et al. Expression and prognostic significance of platelet-derived growth factor and its receptors in epithelial ovarian neoplasms. Cancer Res 1993;53:4550—4554, october 1. 49. Hofmann G.E., Horowitz G.M., Scott R.T., Jr. Navot D. Transforming growth factor-a in human implantation trophoblast: immunogistochemical evidence for autocrine/paracrin function. Clin Endocrinol Metab 1993;76:781—5. 50. Homburg R., West C., Torresani T., Jacobs H.S. Cotreatment with human growth hormon and gonadotropins for induction of ovulation: a controlled clinical trial. Fertil Steril 1990;53:254—9. 51. Horowitz G.M., Scott R.T., Jr. Drews M.R., Navot D., Hofmann G.E. Immunogistochemical localization of transforming growth factor-a in human endometrium, decidua, and trophoblast. J Clin Endocrinol Metab 1993;76:786—92. 52. Insler V., Shoham Z., Barash A. et al. Polycystic ovaries in non-obese and obese patients: possible pathophysiological mechanism based on new interpretation of facts and findings. Hum Reprod 1993;8:379—84. 53. Irwin J.C., Utian W.H., Eckert R.L. Sex steroid and growth factors differentially regulate the growth and differentiation of cultured human endometrial stromal cells. Endocrinology 1991;129:2385—92. 54. Iwashita M., Mimuro T., Watanabe M. et al. Plasma levels of insulin-like growth factor-I and its binding protein in polycystic ovarian syndrome. Horm Res 1990;33:21—6. 55. Jakeman L.B., Winer J., Bennett G.L. et al. Binding sites for vascular endothelial growth factor are localized on endothelial cells in adult rat tissues. J Clin Invest 1992;89:244—253. 56. Jesionowska H., Hemmings R., Guyda H.J. et al. Determination of insulin and insulin-like growth factors in the ovarian circulation. Fertil Steril 1990;33:21—6. 57. Lauber M., Ahlgren R., Waterman M.R., Simpson E.R. Characterization of the 5’-regulatory region of cytochrome P450scc expressed in bovine luteal cells in primary culture. 72nd Annual Meeting of the Endocrine Society, Atlanta Ga. 1990;291. 58. Levine A.C., Ren M., Huber G.K., Kirschenbaum A. Endocrinology 1992;130:4:2413—2419. 59. Li N., Batzer A., Daly R. et al. Ibid. 363:6424:85—88. 60. Li S., Maruo T., Ladines-Illave C. et al. Expression of transforming growth factor-alpha in the human ovary during follicular growth, regression and atresia. Endocr J. 1994;41:693—701. 61. Lund J., Ahlgren R., Wu D-H., Kagimoto M., Simpson E.R., Waterman M.R. Transcriptional regulation of the bovine CYP 17 (P450-17alfa) gene. J Biol Chem 1990;265:5:3304—3312. 62. Mason H., Willis D., Holly J., Franks S. Insulin preincubation enhances insulin-like growth factor-II (IGF-II) action on steroidogenesis in human granulosa cells. J Clin Endocrinol Metab 1994;78:1265—1267. 63. Moller D.E., Flier J.S. Detection of an alteration in the insulin-receptor gene in a patient with insulin resistance, acanthosis nigricans, and the polycystic ovary syndrome (type A insulin resistance). N Engl J Med 1988;319:1526—9. 64. Morgan D.O., Edman J.C., Standring D.N. et al. Insulin-like growth factor II receptor as a multifunctional binding protein. Nature 1987;329:4:301—307. 65. Nestler J.E., Barlascani C.O., Matt D.W. et al. Suppression of serum insulin by diazoxide reduces serum testosterone levels in obese women with polycystic ovary syndrome. J Clin Endocrinol Metab 1989;66:1027—32. 66. Nobels F., Dewailly D. Puberty and polycystic ovarian syndrome: the insulin /insulin-like growth factor I hypothesis. Fertil Steril 1992;58:4:655—666. 67. O’ Keefe F.J., Pledger W.J. Review: a model of cell cycle control:sequential events regulated by growth factors. Moll Cell Endocrinol 1983;31:167—74. 68. Olson T.A., Mohanraj D., Carson L.F. et al: Vascular permeability factor gene expression in normal and neoplastic human ovaries. Cancer Res 1994;54:276—280. 69. Oosterlynck D., Meuleman C., Sobis H., Vandeputte M., Koninckx P. Angiogenic activity of peritoneal fluid from women with endometriosis. Fertil Steril 1993;59:778—782. 70. Owen E.J., Shoham Z., Mason B.A. et al. Co-treatment with growth hormone after pituitary suppression for ovarian stimulation in in vitro fertilization: a randomized, double-bind, placebo-control trial. Fertil Steril 1991;56:1104—10. 71. Pepper M., Ferrara N., Orci L., Montesano R. Vascular endothelial growth factor (VEGF) induces plasminogen activators and plasminogen activator inhibitor-l in microvascular endothelial cells. Biochem Biophys Res Commun 1991;181:902—906. 72. Poretsky L., Grigorescu F., Seibel M. et al. Distribution and characterization of insulin and insulin-like growth factor receptors in normal human ovary. J Clin Endocrinol Metab 1985;61:728—34. 73. Presta M. Sex hormones modulate the synthesis of basic fibroblast growth factor in human endometrial adenocarcinoma cells implications for the neovasculatization of normal and neoplastic endometrium. J Cell Physiol 1988;137:593—7. 74. Rabinovici J., Dandekar P., Angle M. et al. Insulin-like growth factor-I (IGF-I) levels in follicular fluid from human preovulatory follicles: correlation with serum IGF-I levels. Fertil Steril 1990;54:428—433. 75. Raines E.W., Bowen-Pope D.F., Ross R. Platelet-derived growth factor. In: M.B. Sporn and A.B. Roberts (eds.), Peptide Growth Factors and Their Receptors, Berlin: Springer-Verlag, 1990;1:173—262. 76. Ramey J., Archer D. Peritoneal fluid: its relevance to the development of endometriosis. Fertil Steril 1993;60:1—14. 77. Ravindranath N., Little-Ihrig L., Philips H. S. et al. Vascular endothelial growth factor messenger ribonucleic acid expression in the primate ovary. Endocrinology 1992;131:254—260. 78. Richard P., Buyalos M.D. Insulin-like growth factors: clinical experience in ovariian function. Am J of Med 1995; 98(suppl 1A): 55—66. 79. Richards J., Bogovich K. Effects of human chorionic gonadotropin and progesterone on follicular development in the immature rat. Endocrinology. 111:10:1429—1438. 80. Roberts A., Skinner M. Transforming growth factor-alpha and beta differentially regulate growth and steroidogenesis of bovine thecal cells during antral follicle development. Endocrinology, 1991;129:2041—2048. 81. Rolandi E., Barreca T. Neuropharmacological influences on hypothalamic-pituitary secretion. Psychoneuroendocrine Dysfunction. Ed. N. S. Shah, A.G. Donald New York, 1984;41—60. 82. Rusnati M., Casarotti G., Pecorelli S., Ragnotti G. Basic fibroblast growth factor in ovulatory cycle and postmenopausal human endometrium. Growth Factors 1990;3:299—307. 83. Ryan I., Tseng J., Schriock E., Khorram O., Landers D., Taylor R. Interleukin-8 concentration are elevated in peritoneal fluid of women with endometriosis. Fertil Steril 1995;63:929—932. 84. Santoro N., Crowley W. Disorders of endogenous GnRH secretions; hypogonadotropic hypogonadism, polycystic ovarian disease, inadequate luteal phase. Pulsatil GnRH 1986 Poc of the 3-rd Ferring Symposium Nordwijk 11—13/9.1985;51—62. 85. Senger D.R., Perruzzi C.A., Feder J. et al. A highly concerved vascular permeability factor secreted by a variety of human and rodent tumor cell lines. Cancer Res 1986;46:5629—5632. 86. Singh B., Rutledge J. Armstrong D. Epidermal growth factor and its receptor gene expression and peptide localization in porcine ovarian follicles. Mol Reprod Dev 1995;40:391—399. 87. Smits A., Hermansson M., Nister M., Kamushina, I., Heldin C.-H., Westermark B., Funa K. Rat capillary endothelial cells express functional RDGF B-type receptors. Growth Factors 1989;2:1—8. 88. Smits A., Kato M., Westermark B., Nister M., Heldin C.-H., Funa K. Neurotrophic activity of PDGF: rat neuronal cells possess function PDGF b receptors and respond of PDGF. Proc Natl Acad Sci USA 1991;88:8159—8163. 89. Sporn M.B., Roberts A.B., Wakefield L.M., Assoian R.K. Transforming growth factor-b: biological function and chemical structure. Science 1986;233:532—4. 90. Terman B.I., Dougher-Vermazen M., Carrion M.E. et al. Identification of the KDR tyrosine kinase as a receptor for vascular endothelial growth factor. Biochem Biophys Res Commun 1992;187:1579—1586. 91. Thompson T.C., Truong L.D., Park S.H. J Cell Biochen 1992; Suppl. 16H:54—61. 92. Tischer E., Mitchell R., Hartman T. et al. The human gene for vascular endothelial growth factor: multiple protein forms are encoded through alternative exon splicing. J Biol Chem 1991;266:1194—1195. 93. Unemori E., Ferrara N., Bauer E., Amento E. Vascular endothelial growth factor induces interstitial collagenase exspression in human endothelial cells. J Cell Physiol 1992;153: 557—562. 94. Vogel W., Lammers R., Ullrich A. Science 1993;259:5101:1611—1614. 95. de Vries C., Escobedo J.A., Ueno H. et al. The fms-like tyrosine kinase, a receptor for vascular endothelial growth factor. Science 1992;255:989—991. 96. Ziltener H., Maines-bandiera S., Shrader J. Auersperg N. Secretion of bioactive interleukin-1, interleukin-6, and colony-stimulating factors by human ovarian superficial epithelium. Biol Reprod 1993;49:635—641. 97. Zhang Y., Proenca R., Maffei M. et al. Positional cloning of the mouse obese gene and its human homologue. Nature 1994;372:425—432. 98. Zolti M., Ben-Rafael Z., Meirom R. et al. Cytokine involvement inoocytes and early embryos. Fertil Steril 1991;56:265—272. 99. Zolti M., Meirom R., Shemech M. et al. Granulosa cells as a source and target organ for tumor necrosis factor-alpha. FEBS Let
|